
���� A��B��C��D��E��F��GԪ��ԭ��������������Cԭ������������������������֮��Ϊ3��4���������������ܳ���8��ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����CΪOԪ�أ�E��Cͬ���壬��EΪSԪ�أ�Bԭ���������3��δ�ɶԵ��ӣ�ԭ�Ӻ�������Ų�Ϊ1s22s22p3����BΪNԪ�أ�F-��D+��A+���ӵİ뾶��С��������AF������Ϊ���壬��AΪHԪ�ء�DΪNa��FΪCl��G�Ļ�̬ԭ�Ӻ���M�ܲ��������ӣ�N�ܲ�ֻ��1�����ӣ���GΪCuԪ�أ��ݴ˽��
��1��DΪNa��ԭ�Ӻ�����11�����ӣ������������ԭ����д��������Ų���NԪ��2p�ܼ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ�����Ԫ�صģ�ͬ�����Ŷ��е�һ�����ܼ�С��
��2��A��C���γ�18���ӷ���ΪH2O2����ˮ��Һ�е��������Ȼ�����Һʱ���ֽ�����ˮ��������
��3������������Ԫ���е�����Ԫ����ɻ����Ϊ������������������Ҫ�ɷ֣��û�����ΪNClO����Һ�д����������ˮ�⣬��Һ�ʼ��ԣ�
��4��G�ĵͼ���������Cu2O��B������������ˮ������HNO3���÷�Ӧ����ʽΪ��3Cu2O+14HNO3=6Cu��NO3��2+2NO+7H2O��
��5��1mol��̬N2H4������O2��ȼ�գ�����N2����̬H2O���ų�534kJ���������ɵã�
N2H4��g��+O2��g��=N2��g��+2H2O��g����H=-534kJ/mol �٣�
��1 molҺ̬H2O��ȫ����������44 kJ�������ɵã�
H2O��l��=H2O��g����H=+44kJ/mol�ڣ�
���ݸ�˹���ɣ���-�ڡ�2��N2H4��g��+O2��g��=N2��g��+2H2O��l����
��� �⣺A��B��C��D��E��F��GԪ��ԭ��������������Cԭ������������������������֮��Ϊ3��4���������������ܳ���8��ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����CΪOԪ�أ�E��Cͬ���壬��EΪSԪ�أ�Bԭ���������3��δ�ɶԵ��ӣ�ԭ�Ӻ�������Ų�Ϊ1s22s22p3����BΪNԪ�أ�F-��D+��A+���ӵİ뾶��С��������AF������Ϊ���壬��AΪHԪ�ء�DΪNa��FΪCl��G�Ļ�̬ԭ�Ӻ���M�ܲ��������ӣ�N�ܲ�ֻ��1�����ӣ���GΪCuԪ�أ�
��1��D��NaԪ�أ���ԭ�Ӻ�����11�����ӣ����ݹ���ԭ��֪DԪ�ػ�̬ԭ�ӵĺ�������Ų�ʽ1s22s22p63s1��
B��NԪ�أ�C��OԪ�أ�E��SԪ�أ�NԪ��2p�ܼ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ�����Ԫ�صģ�ͬ�����Ŷ��е�һ�����ܼ�С������B��C��E����Ԫ�صĵ�һ�������ɴ�С��˳����N��O��S��
�ʴ�Ϊ��1s22s22p63s1��N��O��S��
��2��A��HԪ�أ�C��OԪ�أ�A��C���γ�18���ӷ��ӣ����������H2O2��˫��ˮ���Ȼ��������������·ֽ�����ˮ����������Ӧ����ʽΪ��2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2����
�ʴ�Ϊ��2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2����
��3��������Ԫ����ɵij�����������������Ҫ�ɷ���NaClO�����������������Ӻʹ����������֮��������Ӽ�����ԭ�Ӻ���ԭ��֮����ڹ��ۼ�������������ǿ�������Σ��������������ˮ��ClO-+H2O?HClO+OH-��ʹ����Һ�ʼ��ԣ�
�ʴ�Ϊ�����Ӽ������ۼ���ClO-+H2O?HClO+OH-��
��4��G�ĵͼ���������Cu2O��B������������ˮ������HNO3���÷�Ӧ����ʽΪ��3Cu2O+14HNO3=6Cu��NO3��2+2NO+7H2O�����ݷ���ʽ֪��0.3molCu2O��1.4mol����ǡ����ȫ��Ӧ��
�ʴ�Ϊ��1.4��
��5��1mol��̬N2H4������O2��ȼ�գ�����N2����̬H2O���ų�534kJ���������ɵã�
N2H4��g��+O2��g��=N2��g��+2H2O��g����H=-534kJ/mol �٣�
��1 molҺ̬H2O��ȫ����������44 kJ�������ɵã�
H2O��l��=H2O��g����H=+44kJ/mol�ڣ�
���ݸ�˹���ɣ���-�ڡ�2��N2H4��g��+O2��g��=N2��g��+2H2O��l����H=-534kJ/mol-2��+44kJ/mol��=-622kJ/mol��
�ʴ�Ϊ��N2H4��g��+O2��g��=N2��g��+2H2O��l����H=-622kJ/mol��
���� ���⿼��Ƚ��ۺϣ��漰�ṹ����λ�ù�ϵӦ�á���������Ų��������ܡ���˹���ɡ�����ˮ�⡢������ԭ��Ӧ��֪ʶ�㣬��ȷ�ƶ�Ԫ���ǽⱾ��ؼ���ע��ͬ���ڵ�һ�������쳣������Ѷ��еȣ�


 С�����ϵ�д�
С�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢ� | B�� | �ۢܢݢ� | C�� | �٢ۢ� | D�� | �٢ۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڷ�Ӧ����������ԭ��Ӧ | |
| B�� | KI��������Ӧ������������� | |
| C�� | KI��������Ӧ���������������� | |
| D�� | ����ҺͻȻ��Ϊ��ɫ����֮�ֺܿ���ʧ����һ������٢ڵķ�Ӧ�����й� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

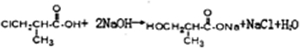 ���߷��ӻ�����H�Ľṹ��ʽΪ
���߷��ӻ�����H�Ľṹ��ʽΪ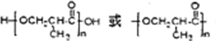 ��
��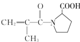 ��F�ж���ͬ���칹�壬��
��F�ж���ͬ���칹�壬�� �ȣ�д����������������F��ͬ���칹��Ľṹ��ʽ��
�ȣ�д����������������F��ͬ���칹��Ľṹ��ʽ��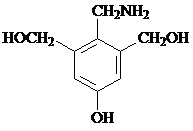 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ����Ӧ���� | �淴Ӧ���� | |
| A | vA=2 mol/��L•min�� | vB=2 mol/��L•min�� |
| B | vA=2 mol/��L•min�� | vC=2 mol/��L•min�� |
| C | vA=1 mol/��L•min�� | vB=2 mol/��L•min�� |
| D | vA=1 mol/��L•min�� | vC=1.5 mol/��L•min�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.3 mol•L-1��Na2SO4��Һ�к��е�Na+��SO42-�������ʵ���Ϊ0.9 mol | |
| B�� | ��1 Lˮ����22.4 L����ʱ���ð�ˮ��Ũ�Ȳ���1 mol•L-1��ֻ�е�22.4 L��������ˮ�Ƶ�1 L��ˮʱ����Ũ�Ȳ���1 mol•L-1 | |
| C�� | ��K2SO4��NaCl�����Ի��ˮ��Һ�У����Na+��SO42-�����ʵ�����ȣ���K+��Cl-�����ʵ���Ũ��һ����ͬ | |
| D�� | 10��ʱ��0.35 mol•L-1��KCl������Һ100 mL������5 gˮ����ȴ��10��ʱ�������С��100 mL���������ʵ���Ũ����Ϊ0.35 mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
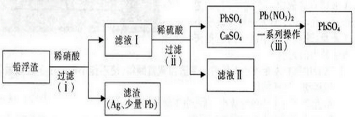
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com