
已知:4NH3(g)+5O2(g) == 4NO(g)+6H2O(g) △H=-1 025kJ/mol,该反应是一个可逆反应。若反应物 起始物质的量相同,下列关于该反应的示意图不正确的是( )
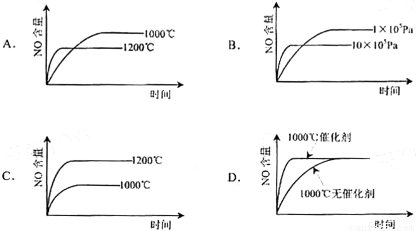
C
【解析】
试题分析:由于该反应的正反应是气体体积增大的放热反应。A.升高温度,化学反应速率加快,达到平衡所需要的时间缩短。当反应达到平衡后,升高温度,根据平衡移动原理,化学平衡向吸热反应方向即向逆反应方向移动,所以NO的平衡含量减小。正确。B.增大压强,物质的浓度增大,反应速率加快,达到平衡所需要的时间缩短。当反应达到平衡后,增大压强,根据平衡移动原理,化学平衡向气体体积减小的方向即向逆反应方向移动,所以NO的平衡含量减小。正确。C.升高温度,平衡向吸热反应方向即向逆反应方向移动,所以NO的平衡含量减小。错误。D加入催化剂后化学反应速率大大加快,达到平衡所需要的时间缩短。当反应达到平衡后,由于催化剂能同等倍数的改变化学反应速率。所以加入催化剂不能使化学平衡发生移动。平衡时NO的含量不变。正确。
考点:考查外界条件对化学反应速率、化学平衡移动影响的知识。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源:2013-2014天津五区县高二下学期期末考试化学试卷(解析版) 题型:选择题
反应后没有颜色变化的是
A.酚与FeCl3 溶液 B.淀粉与碘水
C.酸性K2Cr2O7溶液与C2H5OH D.C3H7Cl与NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省雅安市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
将KClO3、I2各0.02 mol加入12 g 36.5%的盐酸中,I2恰好完全溶解,没有气体产生(不考虑盐酸的挥发)。将反应后的溶液用冰水冷却,析出橙红色晶体A(A在常温下就有升华现象),过滤,将滤液蒸干,收集到KCl固体、8.7g液态水和极少量的A蒸气。则A的化学式可能是
A.I2Cl6 B.HClO C.IClO D. KIO3
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高二化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应式为:2Cl- +2e-=Cl2 ↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- == Cu2+
D.钢铁发生电化学腐蚀的负极反应式:Fe-2e- == Fe2+
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高二化学试卷(解析版) 题型:选择题
已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是 ( )
A.充电时作阳极,放电时作负极 B.充电时作阳极,放电时作正极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高二化学试卷(解析版) 题型:选择题
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
Cd(OH)2+2Ni(OH)2  Cd+2NiO(OH)+2H2O 由此可知,该电池放电时的负极材料是 ( )
Cd+2NiO(OH)+2H2O 由此可知,该电池放电时的负极材料是 ( )
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高一化学试卷(解析版) 题型:填空题
(6分)将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g) xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
①x的数值为 ; ②A的平均反应速率为 ; ③5min时B的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高一化学试卷(解析版) 题型:选择题
纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜” 的有关叙述正确的是( )
A.常温下“纳米铜”比铜片的还原性强,反应时反应速率快
B.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快
C.“纳米铜”与铜是同素异形体
D.常温下“纳米铜”比铜片更易得电子,反应时反应速率快
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市二下学期期末考试化学试卷(解析版) 题型:填空题
(7分)请根据所学化学知识回答下列问题:
(1)在浓度均为0.1 mol/L ①CH3COONH4、②NH4HSO4、③NH3·H2O、④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为 (填序号)。
(2)氯化铝溶液蒸干,灼烧得到的固体物质是_________,用化学方程式说明其原因:
(3)某温度时蒸馏水的pH=6。将2.3 g金属钠放入该蒸馏水中,充分反应后再加该蒸馏水稀释到1 L,恢复到原温度时所得溶液的pH= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com