
分析 (1)根据n=$\frac{m}{M}$计算ag Al3+的物质的量,进而计算$\frac{V}{4}$mL溶液中Al3+的物质的量,根据电荷守恒可知2n(SO42-)=3n(Al3+),据此计算$\frac{V}{4}$mL溶液中SO42-的物质的量,稀释为4VmL,溶液中SO42-的物质的量不变,再根据c=$\frac{n}{4}$计算稀释后溶液SO42-的物质的量浓度.
(2)根据n=$\frac{V}{Vm}$计算物质的量,根据总质量和总物质的量列式计算可得CO和CO2的物质的量,进而计算CO占总体积的比例;
(3)根据n=$\frac{m}{M}$计算6.5gZn的物质的量,根据Zn元素计算生成的n(ZnSO4),根据c=$\frac{n}{V}$计算ZnSO4的物质的量浓度;
根据m=nM计算ZnSO4的质量,根据m=ρV计算溶液的质量,根据溶质质量分数=$\frac{m(溶质)}{m(溶液)}$×100%计算所得反应中硫酸锌的质量分数.
解答 (1)解:ag Al3+的物质的量为$\frac{ag}{27g/mol}$=$\frac{a}{27}$mol,故$\frac{V}{4}$mL溶液中Al3+的物质的量为$\frac{a}{27}$mol×$\frac{1}{4}$=$\frac{a}{108}$mol,
根据电荷守恒可知2n(SO42-)=3n(Al3+),故$\frac{V}{4}$mL溶液中SO42-的物质的量为$\frac{a}{108}$mol×$\frac{3}{2}$=$\frac{a}{72}$mol,
取$\frac{V}{4}$mL溶液稀释到4V mL,则稀释后溶液SO42-的物质的量浓度为$\frac{\frac{a}{72}mol}{4V×10{\;}^{-3}L}$=$\frac{125a}{36V}$mol/L,
故答案为:$\frac{125a}{36V}$mol/L;
(2)标准状况下,Vm=22.4L/mol,n=$\frac{V}{Vm}$=$\frac{33.6L}{22.4L/mol}$=1.5mol,两种气体总的物质的量为1.5mol;设CO的物质的量为x,CO2的物质的量为y,
则有:x+y=1.5,28x+44y=62,解之得:x=0.25mol,y=1.25mol,$\frac{0.25}{1.25}$=$\frac{1}{6}$;
故答案为:1.25mol;1:6;
(3)解:6.5gZn的物质的量为$\frac{6.5g}{65g/mol}$=0.1mol,根据Zn元素可知生成的n(ZnSO4)=0.1mol,故Z所得溶液中ZnSO4的物质的量浓度为$\frac{0.1mol}{0.08L}$=1.25mol/L;
ZnSO4的质量为0.1mol×161g/mol=16.1g,溶液的质量为80mL×1.25g/mL=100g,故所得反应中硫酸锌的质量分数为$\frac{16.1g}{100g}$×100%=16.1%,
答:所得溶液中硫酸锌的物质的量浓度为1.25mol/L,溶质质量分数为16.1%.
点评 本题考查物质的量浓度的有关计算,明确物质的量浓度概念及有关物质的量为核心的计算公式是解题关键,题目难度中等.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱 | |
| B. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| C. | ⅠA金属元素是同周期中金属性最强的元素 | |
| D. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
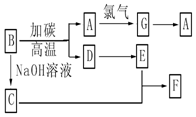 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.
CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A. | 根据表中数据不能计算出混合物中NaHCO3的质量 | |
| B. | 根据表中数据可救出盐酸的物质的量浓度为3mol•L-1 | |
| C. | 加入混合物9.2 g时恰好与盐酸完全反应 | |
| D. | 15.7 g混合物恰好与盐酸完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
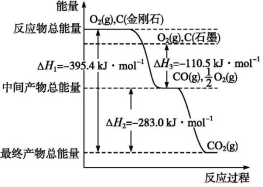 (1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知:
(1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com