
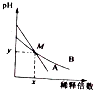
 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )| A. | 稀释前,c(A)=10c(B) | |
| B. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 | |
| C. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L | |
| D. | 由图可知,A为强碱,B为弱碱 |
分析 根据图象可知,室温下,pH相差1的两种一元碱溶液A和B,稀释相同倍数后溶液的pH相等,说明A的pH变化较大,而B的变化较小,则A的碱性大于B.
A.依据图象分析判断AB稀释相同倍数,A的pH变化大;
B.M点AB溶液pH相同;
C.稀释前A溶液中氢氧根离子浓度大于B溶液中;碱是抑制水的电离;
D.由图可知,A为强碱或,B为弱碱.
解答 解:A.稀释前A溶液的pH比B大1,则A溶液中的氢氧根离子浓度为B的10倍,稀释相同倍数后溶液的pH相等,说明A的pH变化较大,而B的变化较小,则A的碱性大于B,A可能为强碱,B为弱碱,或A、B都为弱碱,但A电离出的氢氧根离子浓度大,若A为强碱,B为弱碱,稀释前,c(A)<10c(B),A、B都为弱碱,浓度越大,电离程度越小,稀释前,c(A)<10c(B),故A错误;
B.M点AB溶液pH相同,氢氧根离子浓度相同,所以M点A、B两种碱溶液中阳离子的物质的量浓度相等,故B正确;
C.稀释前A溶液中氢氧根离子浓度大于B溶液中;碱是抑制水的电离;稀释前,A溶液中由水电离出的OH-的浓度小于10-7 mol/L,故C错误;
D.根据图象可知,室温下,pH相差1的两种一元碱溶液A和B,稀释相同倍数后溶液的pH相等,说明A的pH变化较大,而B的变化较小,则A的碱性大于B,A可能为强碱,B为弱碱,或A、B都为弱碱,故D错误;
故选B.
点评 本题考查了根据图示判断碱溶液的强弱及比较溶液中水电离程度大小,题目难度中等,关键合理分析图示,明确图象中pH的变化及交点的意义是解答本题的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铝溶液中滴加过量的氨水:Al3++4OH?═AlO2?+2H2O | |
| B. | 金属铜与浓硝酸反应:3Cu+8H++2NO3?═3Cu2++2NO↑+4H2O | |
| C. | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl?$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++H2O | |
| D. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在实际中可以设计成原电池的是C
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在实际中可以设计成原电池的是C查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅在常温下可以和氢气发生反应 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量最高 | |
| C. | 硅和任何酸都不反应 | |
| D. | 硅在电子工业上是重要的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol CO+2mol H2O(g)+1mol CO2+1mol H2 | |
| B. | 1mol CO+1mol H2O(g)+1mol CO2+1mol H2 | |
| C. | 0.5mol CO+1.5mol H2O(g)+0.4mol CO2+0.4molH2 | |
| D. | 0.5mol CO+1.5mol H2O(g)+0.5molCO2+0.5mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
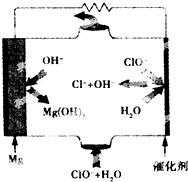 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )| A. | 该燃料电池中镁为负极,发生氧化反应 | |
| B. | 正极反应式为ClO-+H2O+2e-═Cl-+2OH- | |
| C. | 电池总反应式为Mg+ClO-+H2O═Mg(OH)2↓+Cl- | |
| D. | 放电过程中OH-移向正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com