前些天在北京、西安、南昌等25个大中城市都出现雾霾天气,人类的活动改变了全球的气候.全球气候变暖已经成为全世界人类面临的重大问题.
(1)地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO
2以减缓温室效应,主要过程可以描述分为下列三步:
Ⅰ、H
2O(l)═2H
+(aq)+
O
2(g)+2e
-△H═+284kJ?mol
-1Ⅱ、CO
2(g)+C
5H
10O
4 (s)+2H
+(aq)═2C
3H
6O
3+(s)△H═+396kJ?mol
-1Ⅲ、12C
3H
6O
3+(s)+12e
-═C
6H
12O
6(s)+6C
5H
10O
4 (s)+3O
2(g)△H═-1200kJ?mol
-1写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
.
(2)降低大气中CO
2的含量及有效地开发利用CO
2,目前工业上有一种方法是用CO
2来生产燃料乙醇.为探究反
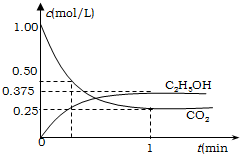
应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO
2和3mol H
2,一定条件下发生反
应:CO
2(g)+3H
2(g)?
CH
3CH
2OH(g)+
H
2O(l)△H=-683kJ?mol
-1.测得CO
2和C
2H
5OH(g)的浓度随时间变化如图所示.
①该反应的平衡常数为
(不必化简);
②关于该反应的下列说法中,正确的是
.
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0
③当反应达到平衡时,H
2的物质的量浓度为c
1,然后向容器中再加入一定量H
2,待反应再一次达到平衡后,H
2的物质的量浓度为c
2.则c
1
c
2的关系(填>、<、=).

 前些天在北京、西安、南昌等25个大中城市都出现雾霾天气,人类的活动改变了全球的气候.全球气候变暖已经成为全世界人类面临的重大问题.
前些天在北京、西安、南昌等25个大中城市都出现雾霾天气,人类的活动改变了全球的气候.全球气候变暖已经成为全世界人类面临的重大问题.

 科学研究发现Cu2O可作为太阳光分解水的催化剂.
科学研究发现Cu2O可作为太阳光分解水的催化剂.