
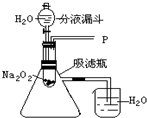
 水能灭火也可以引火.把少量过氧化钠(Na2O2)粉末用干燥脱脂棉包裹(脱脂棉和过氧化钠不反应),将少量水滴到包有过氧化钠的脱脂棉上,则脱脂棉迅速发生燃烧.小明对此现象很感兴趣,于是他和同学们进行如下探究:
水能灭火也可以引火.把少量过氧化钠(Na2O2)粉末用干燥脱脂棉包裹(脱脂棉和过氧化钠不反应),将少量水滴到包有过氧化钠的脱脂棉上,则脱脂棉迅速发生燃烧.小明对此现象很感兴趣,于是他和同学们进行如下探究:| 实验步骤 | 实验现象 | 实验结论 |
分析 实验一:(1)能使带火星的木条复燃,说明该气体具有助燃性,发生的反应是过氧化钠和水反应生成氢氧化钠和氧气,反应中 氧元素化合价-1价变化为-2价和0价,过氧化钠做氧化剂和还原剂,化学方程式计算生成1mol氧气电子转移2mol;
(2)导管口有气泡冒出,说明吸滤瓶内的压强增大,而反应是在试管内发生,不是在吸滤瓶内发生,所以是试管内发生的反应放出热量,使吸滤瓶内温度升高,气体压强增大;
实验二:(3)根据质量守恒定律,化学反应前后元素的种类不变;根据检验碳酸根离子的方法进行分析;
(4)根据酚酞溶液遇酸碱溶液的变色情况进行分析.
解答 解:实验一:(1)氧气具有助燃性,能使带火星的木条复燃,说明生成的气体是氧气,发生的反应是过氧化钠和水反应生成氢氧化钠和氧气,反应的方程式为2Na2O2+2H2O=4NaOH+O2↑,反应中 氧元素化合价-1价变化为-2价和0价,过氧化钠做氧化剂和还原剂,化学方程式计算生成1mol氧气电子转移2mol,产生0.2mol的氧气,需要的转移电子0.4mol
故答案为:O2(或氧气);2Na2O2+2H2O=4NaOH+O2↑;Na2O2;Na2O2;0.4;
(2)试管内发生的反应放出热量,使吸滤瓶内的温度升高,气体压强增大,所以会看到导管口有气泡冒出,
故答案为:反应过程中有热量放出,使吸滤瓶内空气受热膨胀;
实验二:(3)根据质量守恒定律,化学反应前后元素的种类不变,反应物中没有碳元素,因而生成物中也不可能有碳元素;碳酸根离子遇到盐酸会反应生成二氧化碳,有气泡冒出,若没有气泡冒出,则说明没有碳酸根离子,
故答案为:根据质量守恒定律,化学反应前后元素的种类不变,而反应物中不含碳元素
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量反应后所得溶液于试管中,滴入稀盐酸 | 没有气泡产生 | 不存在CO32- |
点评 本题考查了物质性质的实验验证分析、物质性质和反应现象是解题关键,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | 3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | D. | CaO+H2O═Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SbCl4 | PbCl4 |
| 熔点/℃ | -90.4 | -70.4 | 5.2 | 120 | -70.4 | -49.5 | -36.2 | -15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各物质的质量保持不变 | B. | 各物质的浓度相等 | ||
| C. | v(逆)=v(正),正、逆反应停止 | D. | X、Y、Z的速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol | B. | 5 mol | C. | 196g | D. | 98g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
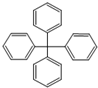
| A. | 其分子式为C25H20 | |
| B. | 分子内的所有碳原子可能共平面 | |
| C. | 完全燃烧生成CO2和H2O的物质的量之比为5:2 | |
| D. | 此分子的一氯代物有三种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的结构简式:C2H4O2 | B. | Cl-的结构示意图为 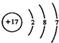 | ||
| C. | 中子数为20 的氯原子:3717Cl | D. | NH3 的电子式: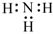 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | SiO2等不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com