
| A. | 往溶液中加入适量的氢氧化钠,使溶液中c(Na+)=c(CH3 COO-) | |
| B. | 将溶液与10 mLpH=10的NaOH溶液混合 | |
| C. | 将溶液与10 mL浓度为a mol•L-1的NaOH溶液混合 | |
| D. | 将溶液稀释到10 L |
分析 A.根据溶液中的电荷守恒分析;
B.pH=4的醋酸溶液中醋酸的浓度大于10-4mol/L,pH=10的NaOH的浓度等于10-4mol/L;
C.等物质的量的醋酸与氢氧化钠恰好反应生成醋酸钠;
D.稀释103倍促进醋酸电离,pH变化小于3个单位.
解答 解:A.常温下,10mL浓度为a mol•L-1的CH3COOH溶液的pH=4,往溶液中加入适量的氢氧化钠,使溶液中c(Na+)=c(CH3 COO-),溶液中电荷守恒为c(Na+)+c(H+)=c(CH3 COO-)+c(OH-),所以c(H+)=c(OH-),即溶液显中性,pH=7,故A正确;
B.pH=4的醋酸溶液中醋酸的浓度大于10-4mol/L,pH=10的NaOH的浓度等于10-4mol/L,二者等体积混合,醋酸过量,溶液显酸性,则pH<7,故B错误;
C.10mL浓度为a mol•L-1的CH3COOH溶液10 mL浓度为a mol•L-1的NaOH溶液混合,二者等物质的量恰好反应生成醋酸钠,醋酸钠在溶液中水解显碱性,即pH>7,故C错误;
D.将溶液稀释到10 L,即稀释103倍,促进醋酸电离,溶液的pH变化小于3个单位,所以溶液的pH<7,故D错误.
故选A.
点评 本题考查了弱电解质的电离平衡、溶液稀释离子浓度的变化、离子浓度大小的分析判断,题目难度不大,注意电荷守恒的应用,侧重于考查学生的分析能力.,


科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g.mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 3.48 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.32 | 158 |
| 氯化钠 | 0.08 | 58.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
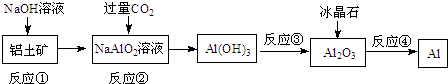
| A. | 流程中涉及的反应均为非氧化还原反应 | |
| B. | 反应②产生的阴离子主要为CO32- | |
| C. | 实验室中完成反应③应在蒸发皿中进行 | |
| D. | 反应①中发生的主要反应为:Al2O3+2OH-=2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向BaCl2溶液中加入足量Na2CO3溶液后,静置,向上层清澈中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀 | |
| B. | 淀粉在稀硫酸的作用下水解后,加NaOH溶液使溶液呈碱性,加入新制Cu(OH)2,加热,若有砖红色沉淀生成,说明淀粉已经完全水解 | |
| C. | 将NaSO4•10H2O晶体置于坩埚内加热,称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水 | |
| D. | 用酸式滴定管向滴有酚酞的NaOH溶液中滴加HCl溶液,若滴入最后一滴HCl溶液后红色刚好褪去,且30s内颜色不复原,说明NaOH已完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
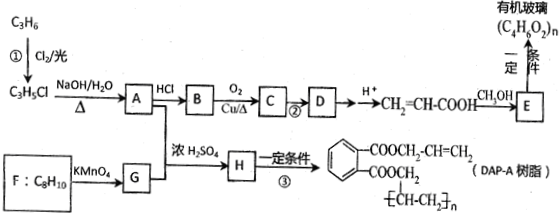
 ;
;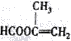 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com