
| A. | 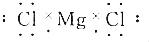 | B. | 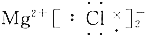 | ||
| C. | 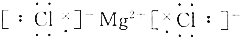 | D. | 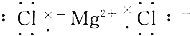 |
科目:高中化学 来源: 题型:选择题
| A. | 过量的铁粉与氯气反应生成FeCl2 | |
| B. | 少量SO2通入Ca(ClO)2 溶液生成CaSO3沉淀 | |
| C. | 常温下,1 mol Fe与足量浓硝酸反应,转移2NA个电子 | |
| D. | 硅酸钠的水溶液是制备硅胶和木材防火剂的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=9.0mol/(L•min) | B. | v(B)=0.6 mol/(L•s) | C. | v(C)=0.3 mol/(L•s) | D. | v(D)=0.1 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向10mL 1mol/LNaOH溶液中先加入3滴1mol/LMgCl2溶液,再加入3滴1mol/LFeCl3溶液 | 现有白色沉淀,后为红褐色沉淀 | Mg(OH)2转化为Fe(OH)3 |
| B | 向某氯化亚铁溶液中,加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
| C | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 有白色沉淀生成 | 溶液X中一定含有CO32-或HCO3- |
| D | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液 | 前者为黄色沉淀,后者为红褐色液体 | 温度升高,Fe3+的水解程度增大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g N2O2晶体中阴离子数目为0.2NA | |
| B. | 含1mol NH4Cl和少量NH3•H2O的中性溶液中,NH${\;}_{4}^{+}$数目为NA | |
| C. | 电解精炼铜时,阳极质量减少64g外电路导线上通过的e-数目为NA | |
| D. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产硫酸时,使用热交换器可以充分利用反应中所放出的热量 | |
| B. | 工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的 | |
| C. | 工业上用离子交换膜法电解饱和食盐水制烧碱 | |
| D. | 工业上采用电解(省电能30%)的AlCl3-KCl熔融体的方法制取金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
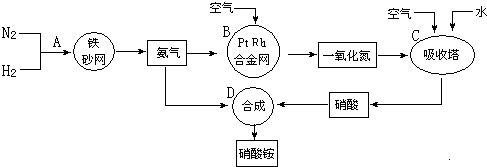
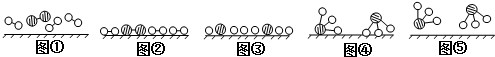
 、
、 、
、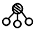 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
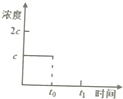 请你利用所学反应原理知识解决下列问题:
请你利用所学反应原理知识解决下列问题:| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.96×10-5 |
| HClO | HClO?ClO-+H+ | 3.0×10-8 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.4×10-7 K2=5.6×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com