
| 1 | 2 | 3 | 4 | 5 | 6 |
| n(CO2) |
| n(KOH) |
| 1 |
| 2 |
| n(CO2) |
| n(KOH) |
| n(CO2) |
| n(KOH) |
| 1 |
| 2 |
| 1 |
| 2 |
| n(CO2) |
| n(KOH) |
| n(CO2) |
| n(KOH) |
| ������� | �� | �� | �� | �� | �� |
| ������� | K2CO3��KOH | K2CO3 | KHCO3��K2CO3 | KHCO3 |
| 0.95mol |
| 0.3mol |


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Mg | ||
B��
| ||
| C��6.02��1023Mg | ||
D��
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѹǿ/pa | 2��105 | 5��105 | 1��106 |
| c��A��/mol?L-1 | 0.08 | 0.20 | 0.44 |
| A����ѹǿ��2��105Pa�����ӵ�5��105Paʱ��ƽ�������ƶ� |
| B����ѧ��������m+n=p |
| C����ѹǿ��5��105Pa�����ӵ�1��106Paʱ��ƽ�ⲻ�ƶ� |
| D��ѹǿ����1��106Paʱ��ƽ�ⳣ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ۢݢܢޢ٢� |
| B���ޢݢۢܢ٢� |
| C���ޢۢݢܢ٢� |
| D���ޢۢݢܢڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��25��ʱ����Mg��OH��2������Һ�м��������� NH4Cl���壬c��Mg2+������ |
| B��25��ʱ����Mg��OH��2��Һ�뱥��MgF2��Һ��ȣ�ǰ�ߵ�c��Mg2+���� |
| C��25��ʱ��Mg��OH��2������20mL0.1mol/L��ˮ�е�Ksp����20mL0.1mol/L NH4Cl��Һ�е�KspС |
| D��25��ʱ����Mg��OH��2������Һ����NaF��Һ��Mg��OH��2������ת����ΪMgF2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��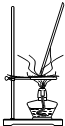 ���չ��� |
B�� ���� |
C��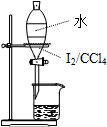 ��Һ |
D�� ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com