
【题目】如图为NaCl晶体的一个晶胞,测知氯化钠晶体中相邻的Na+与Cl-的距离为a cm,该晶体密度为d g·cm-3,则阿伏加德罗常数可表示为多少________________________(书写计算的步骤)。

【答案】一个NaCl晶胞中含Na+:8×![]() +6×
+6×![]() =4(个);含Cl-:12×
=4(个);含Cl-:12×![]() +1=4(个),一个NaCl晶胞的体积为V=8a3cm3,由NA·d·V=4×58.5 g·mol-1得NA=
+1=4(个),一个NaCl晶胞的体积为V=8a3cm3,由NA·d·V=4×58.5 g·mol-1得NA=![]() =
=![]() mol-1
mol-1
【解析】
由氯化钠晶体中相邻的Na+与Cl-的距离为a cm,可求出1个晶胞的体积,再利用该晶体密度为d g·cm-3,可求出一个晶胞的质量。利用相对分子质量,可求出1mol晶胞的质量,由此便可求出1mol晶胞中所含晶胞的个数,从而求出阿伏加德罗常数。
一个NaCl晶胞中所含的微粒数为:含Na+:8×![]() +6×
+6×![]() =4(个);含Cl-:12×
=4(个);含Cl-:12×![]() +1=4(个),从而得出1个晶胞由4个“NaCl”构成;一个NaCl晶胞由8个小立方体构成,其体积为V=8a3cm3,1mol晶胞的质量为4×58.5 g·mol-1,从而得出NA·d·V=4×58.5 g·mol-1,故NA=
+1=4(个),从而得出1个晶胞由4个“NaCl”构成;一个NaCl晶胞由8个小立方体构成,其体积为V=8a3cm3,1mol晶胞的质量为4×58.5 g·mol-1,从而得出NA·d·V=4×58.5 g·mol-1,故NA=![]() =
=![]() mol-1。答案为:一个NaCl晶胞中含Na+:8×
mol-1。答案为:一个NaCl晶胞中含Na+:8×![]() +6×
+6×![]() =4(个);含Cl-:12×
=4(个);含Cl-:12×![]() +1=4(个),一个NaCl晶胞的体积为V=8a3cm3,由NA·d·V=4×58.5 g·mol-1得NA=
+1=4(个),一个NaCl晶胞的体积为V=8a3cm3,由NA·d·V=4×58.5 g·mol-1得NA=![]() =
=![]() mol-1。
mol-1。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】为了从海带浸取液中提取碘,某同学设计了如图实验方案:下列说法正确的是( )
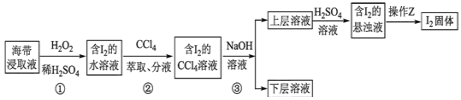
A.①中反应的离子方程式:2I-+H2O2═I2+2OH-
B.②中分液时含I2的CCl4溶液从分液漏斗上口倒出
C.③操作使用的是反萃取法,得到的上层溶液中含有I-
D.操作Z的名称是蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚苯乙烯是一种无毒、无臭的热塑性材料,被广泛应。工业由苯和乙烯为原料制备聚苯乙烯的流程如 下图所示(部分条件略去),下列说法错误的是( )

A.过程①生成乙苯,反应类型为加成反应
B.过程②生成苯乙烯,苯乙烯16个原子一定共面
C.过程③原子利用率为100%,反应类型为加聚反应
D.上述流程中涉及的五种有机物均可使溴水或高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组模拟工业上回收分银渣中的银,过程如下:

(1)Na2SO3溶液和氨水均可作浸出剂,但由于氨水易______(填物理性质),故用Na2SO3溶液更环保。
(2)Ⅰ中主要反应:AgCl + 2![]()
![]()
![]() + Cl-。研究发现:其他条件不变时,该反应在敞口容器中进行,浸出时间过长会使银的浸出率(浸出液中银的质量占起始分银渣中银的质量的百分比)降低,可能原因是______(用离子方程式表示)。
+ Cl-。研究发现:其他条件不变时,该反应在敞口容器中进行,浸出时间过长会使银的浸出率(浸出液中银的质量占起始分银渣中银的质量的百分比)降低,可能原因是______(用离子方程式表示)。
(3)研究发现:浸出液中含银化合物总浓度与含硫化合物总浓度及浸出液pH的关系如下图。

①pH=10时,含银化合物总浓度随含硫化合物总浓度的变化趋势是______。
②解释①中变化趋势的原因:______。
③pH=5时,含银化合物总浓度随含硫化合物总浓度的变化与pH=10时不同,原因是___。
(4)将Ⅱ中反应的离子方程式补充完整:
□__![]() +□___OH- +□______ = □______ +□______ +□______ + CO32-
+□___OH- +□______ = □______ +□______ +□______ + CO32-
(5)Ⅲ中回收液可直接循环使用,但循环多次后,银的浸出率会降低。从回收液离子浓度变化和反应限度的角度分析原因:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:

(1)X难溶于水、易溶于有机溶剂,其晶体类型为________。
(2)M所含元素的电负性由大到小顺序为_______,N原子以_____轨道与O原子形成σ键。
(3)上述反应中断裂和生成的化学键有______(填序号)。
a.离子键
b.配位键
c.金属键
d.范德华力
e.共价键
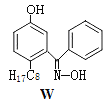
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_____。
(5)基态Cu2+的外围电子排布式为________,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是___________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值) ( )
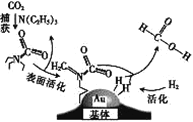
A.标准状况下,22.4 L CO2中所含的电子数目为16NA
B.10.1g N(C2H5)3中所含的非极性共价键数目为1.8NA
C.2 mol Au与2 mol H2中所含的分子数目均为2NA
D.100g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
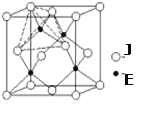
【题目】下表是前20号元素中的部分元素的一些数据:
A | B | C | D | E | F | G | H | I | J | |
原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
试回答下列问题:
(1)以上10种元素电负性最大的是_____(填元素符号)。比元素B原子序数大7的元素在元素周期表中的位置:第_____周期,第_____族,其基态原子的核外电子排布式是________。
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)__________。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中共形成________个σ键,________个π键。
(4)I与氢元素形成的10电子分子X的空间构型为________;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到的络离子的化学式为________,其中X与Cu2+之间以_____________键结合。
(5)下图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
a._________________________________。
b._________________________________。
(6) 如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为_________,若晶胞边长为a cm,则晶体的密度为_______________(用含a、NA的代数式表示)(g/mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同分异构现象在有机物中广泛存在,如图为苯及其几种同分异构体的键线式,下列有关说法中正确的是

A. b、c均与乙烯互为同系物
B. a和d的二氯代物均有3种
C. 4种有机物均能使酸性高锰酸钾溶液褪色
D. a和b中所有原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物甲与乙在一定条件下可反应生成丙:

下列说法正确的是
A. 甲与乙生成丙的反应属于取代反应
B. 甲分子中所有原子共平面
C. 乙的一氯代物有2种
D. 丙在酸性条件下水解生成 和CH318OH
和CH318OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com