
【题目】向FeCl2溶液中滴加NaOH溶液,先产生_______沉淀,马上变成_______色最后转化成______色。
科目:高中化学 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s) ![]() CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) ![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) ![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=![]()
B. 反应③的平衡常数K=![]()
C. 对于反应③,恒容时,温度升高,H2的浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2的浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知少量碳酸钠与足量盐酸反应,有二氧化碳气体放出;而少量盐酸与过量碳酸钠反应,则生成碳酸氢钠和氯化钠,无气体放出.现有A、B两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液.为测定两瓶溶液的成分及物质的量浓度,进行以下实验: ①取20mL A溶液,向其中缓慢滴入B溶液25mL,共收集到112mL(标准状况)气体.
②取25mL B溶液,向其中缓慢滴入A溶液20mL,共收集到56mL(标准状况)气体.
(1)写出少量盐酸与过量碳酸钠反应,无气体放出的离子方程式;
(2)为使上述①②反应完全,还需加入;(填“稀盐酸”或“碳酸钠溶液”)A溶液的物质的量浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在工业生产、生活中有重要的作用
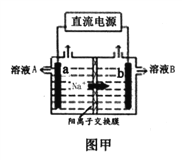
(1)图甲是工业上用惰性电极电解饱和食盐水的原理示意图,a电极为_______极,电极反应式为________,溶液B为_______溶液,电解总反应的离子方程式为_____________.标况下生成33.6Cl2,通过离子交换膜的Na+物质的量为__________.
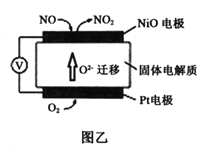
(2)通过NO传感器可检测NO的质量,其工作原理示意图如图乙。Pt电极上发生的是_________反应(填“氧化”或“还原”);写出NiO电极的电极反应式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2作为资源再利用是重要的研究课题,工业上用CO2产生燃料甲醇的化学方程式:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。回答下列问题:
CH3OH(g)+H2O(g)。回答下列问题:
(1)由CO2制备甲醇过程涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3
CH3OH(g) △H3
已知反应Ⅰ、反应Ⅱ、反应Ⅲ的化学平衡常数分别为K1、K2、K3,则K1_______(用K2、K3表示)
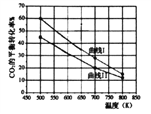
(2)一定条件下,在3L恒容密闭容器中充入一定量的H2和CO2,研究反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线如下图所示。
CH3OH(g)+H2O(g) △H1,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线如下图所示。
①H2和CO2的起始的投入量以A和B两种方式投入:
A:n(H2)=3mol,n(CO2)=1.5mol,
B:n(H2)=3mol,n(CO2)=2mol
曲线Ⅱ代表______(填“A”或“B”)投入方式反应的△H1________0(填“﹥”或“<”)
②在温度为500K的条件下,充入3molH2和1.5molCO2,该反应5min时达到平衡,此温度下的平衡常数为_______(mol·L-1)-2
③500K时,若在此容器中开始充入0.3molH2和0.9molCO2、0.6molCH3OH、0.6molH2O,则反应向______方向进行(“正反应”或“逆反应”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某工业生产过程。

溶解度表:
温度℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
氯化铵 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 55.2 | 65.6 | 71.3 | 77.3 |
硫酸铵 | 70.6 | 73 | 75.4 | 78 | 81 | 88 | 95 | 98 | 103 |
硫酸钾 | 7.4 | 9.3 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 22.9 | 24.1 |
氯化钾 | 28 | 31.2 | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 53.9 | 56.3 |
(1)本工业生产过程的目标产品是____________________________________。(写化学式)
(2)过滤Ⅰ操作所得固体中,除CaCO3外还有一种物质,该固体的用途有_________(试举一例)。
(3)根据溶解度表转化Ⅱ适宜的温度是________
A、0~10℃ B、20~30℃ C、40~60℃ D、90~100℃
过滤Ⅱ操作所得滤渣是__________。
(4)我国著名的化学家也利用了转化Ⅱ的反应原理制备了一种重要的碱,该制备的化学反应方程式为:___________________________________________________
(5)氯化钙结晶水合物(CaCl2·6H2O)进行脱水处理可制得常用的干燥剂,根据下图选择最佳脱水的方法是__________

A、氯化氢气流中加热到174℃ B、直接加热至174℃
C、直接加热至260℃ D、氯化氢气流中加热到260℃
(6)上述工业流程实现了绿色化学的理念,其中__________________(填化学式)实现了循环利用,副产品_________________________(填化学式)可转化为原料,整个流程基本实现了污染物零排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 对于平衡体系:2NO2(g)![]() N2O4(g),缩小容器体积后颜色先加深后变浅,但仍比原来的颜色深
N2O4(g),缩小容器体积后颜色先加深后变浅,但仍比原来的颜色深
B. 某研究性学习小组为研究酸雨的成分,收集一部分酸雨测其pH,结果一天后再测,发现雨水的pH 减小
C. 光照新制氯水时,溶液的pH 逐渐减小
D. 合成氨工厂通常采用20MPa~50MPa 的高压,以提高原料的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲用化学方法测量一个不规则的容器的体积,取14.3g Na2CO310H2O放入100mL烧杯中,加入50mL水配成溶液,将溶液转移到该容器中,用蒸馏水稀释到完全充满该容器,从中取出10mL该溶液,然后逐滴滴入质量分数为3.65%(密度为1g/cm3)的稀盐酸直至没有气体放出为止,用去该稀盐酸10mL.求:
(1)该容器的容积.
(2)所得CO2在标况下的体积.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com