
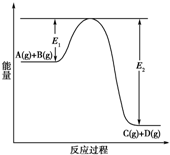
 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如下图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如下图所示,回答下列问题.分析 (1)由图可知,反应物的总能量大于生成物的总能量;
(2)该反应为放热反应,则升高温度,平衡逆向移动;
(3)催化剂对平衡移动无影响,不改变反应的起始状态;
(4)加催化剂,降低反应所需的活化能.
解答 解:(1)由图可知,反应物的总能量大于生成物的总能量,则该反应为放热反应,故答案为:放热;
(2)该反应为放热反应,则升高温度,平衡逆向移动,可知A的转化率减小,故答案为:减小;
(3)催化剂不改变反应的起始状态,加入催化剂对反应热无影响,故答案为:无;
(4)加催化剂,降低反应所需的活化能,则E1和E2均减小,故答案为:减小;减小.
点评 本题考查化学平衡移动及反应热,为高频考点,把握温度、催化剂对平衡的影响等为解答的关键,侧重分析与应用能力的考查,注意催化剂不影响平衡移动,题目难度不大.


科目:高中化学 来源: 题型:推断题
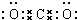 .
.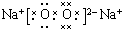 ,其存在的化学键是离子键和非极性键
,其存在的化学键是离子键和非极性键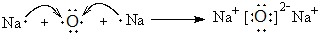 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
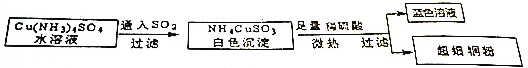
| A. | SO2在此过程中作氧化剂 | |
| B. | 超细铜粉能导电,所以超细铜粉是电解质 | |
| C. | 工业上常用电解法冶炼铜 | |
| D. | 理论上制得1mol铜粉,共转移3mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
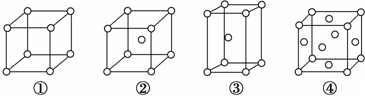
| A. | ②为六方最密堆积,③为体心立方堆积 | |
| B. | ③和④的配位数都是12 | |
| C. | 完全属于④的金属原子数为6个 | |
| D. | ③的空间利用率小于④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;水溶液PH=8,则C(HY-)+2C(H2Y)=10-6-10-8mol/L(填精确值).
;水溶液PH=8,则C(HY-)+2C(H2Y)=10-6-10-8mol/L(填精确值).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 带相反电荷离子之间的相互吸引称为离子键 | |
| B. | 金属元素与非金属元素化合时,不一定形成离子键 | |
| C. | 某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键 | |
| D. | 非金属原子间不可能形成离子键,存在离子键的化合物一定是离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com