
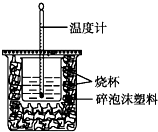
 ��֪H+��aq��+OH-��aq���TH2O��l����H=-57.3kJ•mol-1����50mL0.50mol•L-1������50mL0.55mol•L-1NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
��֪H+��aq��+OH-��aq���TH2O��l����H=-57.3kJ•mol-1����50mL0.50mol•L-1������50mL0.55mol•L-1NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺���� �ٸ������ȼƵĹ������жϸ�װ�õ�ȱ��������
�ڸ����к��ȵļ��㹫ʽ��H=-$\frac{cm��T}{n}$��ȷ��ʵ������Ҫ�����ݣ�
��������Ч�����ã�������ɢʧ����õ��к�����ֵ�����С��
�ܸ���������ʵ������ȷ�����
��� �⣺�������ȼƵĹ����֪��װ�õ�ȱ�������ǻ��β�����������ʴ�Ϊ�����β����������
���ɷ�Ӧ�ȵļ��㹫ʽ��H=-$\frac{cm��T}{n}$��֪����Ӧ���к��ȼ���ʱ��������Ҫ�������У������ݣ����Ũ�Ⱥ���������Ũ�Ⱥ��������Ӧǰ���¶ȱ仯��T��Ȼ��������Ӧ����Һ������������ˮ�����ʵ�����
��ѡA��
��������Ч�����ã�������ɢʧ����õ��к�����ֵ�����С����H����-57.3kJ•mol-1��
�ʴ�Ϊ��ʵ�����������������ɢʧ��
�ܰ�ˮΪ����������Ϊ���ȹ��̣�����ͬŨ�Ⱥ�����İ�ˮ��NH3•H2O������NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵƫС���ʴ�Ϊ��ƫС��
���� ���⿼��ⶨ��Ӧ�ȵ�ԭ�������������Ѷ��еȣ�ע�������к��ȵĸ��


 ����˼ά�żӿ���ϵ�д�
����˼ά�żӿ���ϵ�д� �����Ծ�ϵ�д�
�����Ծ�ϵ�д� �ο�����������100��ϵ�д�
�ο�����������100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ���ǣ�������
���ǣ�������| A�� |  | B�� |  | C�� | ��ϩ�� | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cl-��Cl2 | B�� | H2��H+ | C�� | CuO��Cu | D�� | Zn��Zn2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2SO4 | B�� | H20 | C�� | HCl | D�� | Na2C03 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �õ�1 mol e- | B�� | ʧȥ1 mol e- | C�� | ʧȥ2 mol e- | D�� | û�е��ӵ�ʧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.05mol | B�� | 0.1mol | C�� | 0.25mol | D�� | 0.5mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼��������Һ�е�������������Һ��HCO3-+OH-�TCO32-+H2O | |
| B�� | ��NH4HCO3��Һ�мӹ���NaOH��Һ�����ȣ�NH4++OH-�TNH3��+H2O | |
| C�� | ���������������������䰱ˮ�У�SO2+NH3•H2O�THSO3-+NH4+ | |
| D�� | ��������Һ�������Һ��ϣ�SiO32-+2H+�TH2SiO3�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com