
| A. | H2 | B. | HCl | C. | O2 | D. | CO2 |
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他现象,说明原溶液中一定含有SO42- | |
| B. | 取少量久置的Na2SO3样品于试管中加水溶解,再加足量盐酸酸化,然后加BaCl2溶液,若加HCl时有气体产生,加BaCl2时有白色沉淀产生,说明Na2SO3样品已部分被氧化 | |
| C. | 向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32-或SO32- | |
| D. | 将某气体通入品红溶液中,品红溶液褪色,该气体一定是SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
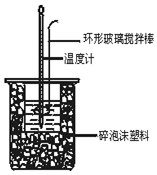 Ⅰ、已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:
Ⅰ、已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
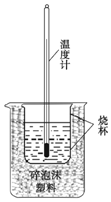 实验室利用如图装置进行中和热的测定. 回答下列问题:
实验室利用如图装置进行中和热的测定. 回答下列问题:| 反应物 | 起始温度(℃) | 终了温度(℃) | 中和热(kJ•mol-1) |
| ①HCl+NaOH | 13 | 19.8 | -a |
| ②HCl+NH3•H2O | 13 | 19.3 | -b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
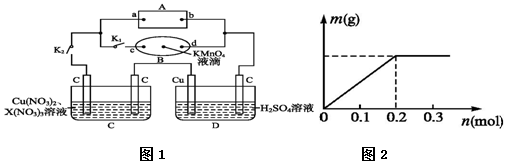
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m-0.48 | B. | m-0.72 | C. | m-0.8 | D. | m-1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始加入合金的质量可能为5.6g | |
| B. | 参加反应的硝酸的物质的量为0.2mol | |
| C. | 沉淀完全时消耗NaOH溶液的体积为200mL | |
| D. | 标况下产物NO体积为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、Cl-、NO3- | B. | NH4+、SO42-、Na+、OH- | ||
| C. | Cu2+、Fe3+、NO3-、Cl- | D. | H+、Na+、HCO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com