
| A. | 与150mL0.1 mol•L-1硫酸钠溶液中的c(SO42-)相同 | |
| B. | 向该溶液中逐滴加入Ba(OH)2溶液至过量,最终沉淀全部溶解 | |
| C. | 若用铝片或氧化铝分别与稀硫酸反应得到该溶液,则消耗的硫酸的物质的量相同 | |
| D. | 若向该溶液中分别逐滴加入100mL0.5mol•L-1NaOH溶液或氨水,得到沉淀量相同 |
分析 A.离子的浓度与溶液体积大小无关,结合硫酸铝和硫酸钠的化学式组成分析;
B.最终氢氧化铝沉淀完全溶解,但硫酸钡不会溶解;
C.根据硫酸根离子守恒分析;
D.氢氧化铝沉淀能够溶于氢氧化钠.
解答 解:A.50mL0.1mol•L-1硫酸铝溶液中c(SO42-)=0.2mol/L,150mL0.1 mol•L-1硫酸钠溶液中的c(SO42-)=0.1mol/L,两溶液中的c(SO42-)不同,故A错误;
B.向硫酸铝溶液中逐滴加入Ba(OH)2溶液至过量,氢氧化铝沉淀完全溶解,但硫酸钡沉淀不溶解,故B错误;
C.若用铝片或氧化铝分别与稀硫酸反应得到该溶液,两溶液中含有硫酸根离子的物质的量相等,根据质量守恒可知消耗的硫酸的物质的量相同,故C正确;
D.50mL0.1mol•L-1硫酸铝溶液中含有铝离子的物质的量为0.01mol,100mL0.5mol•L-1NaOH溶液或氨水中含有溶质的物质的量为0.05mol,碱溶液过量,氢氧化钠能够溶解完全溶解氢氧化铝,而氨水不溶解氢氧化铝,所以得到沉淀的量不同,故D错误;
故选C.
点评 本题考查物质的量的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握物质的量与其它物理量之间的关系,D为易错点,正确判断过量情况为解答关键,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验方案 | 所选玻璃仪器 | |
| A | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 | 酒精灯、烧杯、玻璃棒 |
| B | 海带提碘 | 将海带剪碎,加蒸馏水浸泡,取滤液加稀硫酸和H2O2 | 试管、胶头滴管、烧杯、漏斗 |
| C | 测定饱和NaClO溶液、CH3COONa溶液的pH值 | 分别蘸取两种溶液滴在pH试纸上,颜色稳定后与标准比色卡对照 | 玻璃捧、玻璃片 |
| D | 配制480ml0.5mol/LCuSO4溶液 | 将称量好的 62.5g CuSO4•5H2O 溶解、冷却、转移、洗涤、定容、摇匀 | 烧杯、玻璃棒、量筒、一定规格的容量瓶、胶头滴管 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
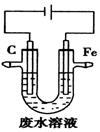
| A. | 石墨极上发生氧化反应 | |
| B. | 阳极的电极反应式为Fe-3e-=Fe3+ | |
| C. | 除去Cr2O72-的反应:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 随着电解的进行,石墨极附近电解质溶液的pH会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 用途 |
| A | Fe3+有氧化性 | 可用饱和FeCl3溶液制备Fe(OH)3胶体 |
| B | SiO2有导电性 | 可用SiO2制光导纤维 |
| C | NH3有还原性 | 可用NH3制取NO |
| D | 浓HNO3有酸性 | 可用铁制容器盛放浓HNO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠能从水溶液中置换出铜 | |
| B. | 钠长期置于空气中,最后变成碳酸钠 | |
| C. | 钠和氧气反应,条件不同,产物不同 | |
| D. | 钠与水反应时,钠熔成小球在水面四处游动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
  | ||||
| 酸 | 碱 | 盐 | … | |
| 实例 | ①HCl ②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2SO3或K2SO3 | ⑦SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构.
据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
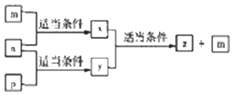 A、B,C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、n、p分别是元素A、C、B、的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且z是用于配制饮料,它们之间有如下转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )
A、B,C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、n、p分别是元素A、C、B、的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且z是用于配制饮料,它们之间有如下转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )| A. | D的单质起火燃烧时可用x作灭火剂 | |
| B. | 元素的非金属性:C>A>B | |
| C. | 原了半径:D>C>B>A | |
| D. | B与同族元素的氧化物可发生置换反应,并且做还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCN中碳元素化合价为+2价 | |
| B. | H2O2在该反应中做还原剂 | |
| C. | NaCN中含有离子键和极性共价键 | |
| D. | 生成0.1 mol NH3时,有0.2 mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com