
| A. |  比较非金属性强弱:S>C>Si 比较非金属性强弱:S>C>Si | B. |  分离CH3COOC2H5和饱和碳酸钠溶液 分离CH3COOC2H5和饱和碳酸钠溶液 | ||
| C. |  观察纯碱的焰色反应 观察纯碱的焰色反应 | D. |  比较Na2CO3和NaHCO3的热稳定性 |
分析 A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;
B.互不相溶的液体采用分液方法分离;
C.铂丝的焰色反应呈无色,钠元素焰色反应呈黄色;
D.小试管的温度较低,碳酸氢钠应放在套装小试管中.
解答 解:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,硫酸和碳酸钠反应生成二氧化碳、二氧化碳和硅酸钠反应生成难溶性硅酸,所以硅酸钠溶液中产生沉淀,该实验能证明非金属性S>C>Si,故A正确;
B.乙酸乙酯和碳酸钠溶液不互溶,可以采用分液方法分离,故B正确;
C.铁丝的焰色反应为无色,可用来做纯碱的焰色反应,能够达到实验目的,故C正确;
D.套装小试管加热温度较低,碳酸氢钠应放在套装小试管中,通过澄清水是否变浑浊可证明稳定性,题中装置无法达到实验目的,故D错误;
故选D.
点评 本题考查化学实验方案评价,涉及焰色反应、非金属性强弱判断、物质分离和提纯、物质稳定性强弱判断等知识点,侧重于学生的分析能力和实验能力的考查,为高考常见题型,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 化学反应 | 催化剂 | Ea/KJ•mol-1 | k(催)/k(无) | |
| 无催化剂 | 有催化剂 | |||
| C12H22O11(蔗糖)+H2O═ C6H12O6 (葡萄糖)+C6H12O6(果糖) | 蔗糖酶 | 107 | 36 | 9.2×1011(310K) |
| 2HI═H2+I2 | 金 | 184 | 105 | 1.6×108(503K) |
| CH3CHO═CH4+CO | 碘 | 210 | 136 | 7.5×104(793K) |
| 2H2O2═2H2O+O2 | 过氧化氢酶 | 75 | 25 | 5.8×108(298K) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | C(N2)/mol.L-1 | C(H2)/mol.L-1 | C(NH3)/mol.L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
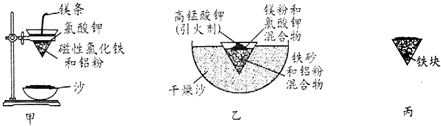
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 分液操作时,下层液体从分液漏斗下口放出后再将上层液体从下口放出到另一个烧杯中 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铜片上 Cu+2H+=Cu2++H2↑ | |
| B. | 氢氧化镁与盐酸的反应 H++OH-=H2O | |
| C. | 澄清石灰水与盐酸的反应 Ca(OH)2+2H+=Ca2++2H2O | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| B. | 0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+2ClO-=SO42-+Cl-+HClO | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:NH4++H++SO42-+Ba2++2OH-=NH3?H2O+BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com