
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 溶液不变浑浊,证明固体中不含碳酸铵. |
| 步骤3:向试管中继续加入少量澄清石灰水. | 溶液变浑浊,证明固体中含有碳酸氢铵. |
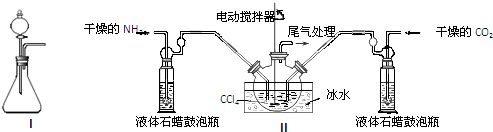
分析 (1)装置1是利用分液漏斗滴入液体溶解锥形瓶中的固体,利用溶解放热使氨水分解生成氨气;
(2)①反应是放热反应降温平衡正向进行;液体石蜡鼓泡瓶的主要作用是控制反应进行程度,控制气体流速和原料气体的配比;
②生成的氨基甲酸铵小晶体悬浮在四氯化碳中,分离产品的实验方法利用过滤得到,氨基甲酸铵(NH2COONH4)是一种白色固体,易分解;
(3)①根据实验目的,检验氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种,通过向试管中加入过量的BaCl2溶液,静置溶液不变浑浊,证明固体中不含碳酸铵;在不含碳酸铵的基础上在通过向试管中加入少量澄清石灰水,看溶液是否变浑浊证明固体中是否含有碳酸氢铵;
②碳酸氢铵的氨基甲酸铵样品中,使碳元素完全转化为碳酸钙,依据碳元素守恒和混合物质量计算物质的量分数.
解答 解:(1)把浓氨水滴入到固体氧化钙或氢氧化钠或碱石灰,在溶解过程中放热使浓氨水分解生成氨气,
故答案为:浓氨水与氢氧化钠固体(或浓氨水与碱石灰或浓氨水与生石灰)等;
(2)①反应2NH3(g)+CO2(g)?NH2COONH4(s)+Q,是放热反应,降温平衡正向进行,温度升高;发生器用冰水冷却提高反应物质转化率,防止生成物温度过高分解;液体石蜡鼓泡瓶的作用是控制反应进行程度,控制气体流速和原料气体的配比(或通过观察气泡,控制NH3与CO2的反应速率),
故答案为:降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解);通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率);
②制备氨基甲酸铵的装置如图3所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中,分离产品的实验方法利用过滤得到,氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、不能加热烘干,应在真空40℃以下烘干,
故答案:过滤;c;
(3)①根据实验目的,检验氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种,通过向试管中加入过量的BaCl2溶液,静置溶液不变浑浊,证明固体中不含碳酸铵;在不含碳酸铵的基础上在通过向试管中加入少量澄清石灰水,看溶液是否变浑浊证明固体中是否含有碳酸氢铵,故答案为:
| 实验步骤 | 预期现象和结论 |
| 步骤3:少量澄清石灰水 | 溶液变浑浊 |
点评 本题考查了物质制备实验的设计应用,主要是氨气的制备方法,氨基甲酸的制备实验装置分析判断,实验基本操作,混合物分离的实验设计,有关混合物的计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1 Na2CO3溶液:2c(Na+)=c(HCO3-)+c(CO32?)+c(H2CO3) | |
| C. | 0.1 mol•L-1 NH4Cl溶液:c(NH4+)=c( Cl-) | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ④⑥ | C. | ②③④ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常通过电解熔融的MgO冶炼金属镁 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2 | |
| D. | 在铁上镀铜,应选用铜作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com