

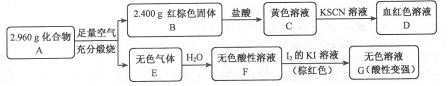
分析 由实验装置可知,加热A处可提供水蒸气,B处发生4H2O(g)+3Fe$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2,D中碱石灰可干燥氢气,E中氢气还原CuO,以此分析(1)~(2);
(3)待B管冷却后,取其中的固体,与过量稀盐酸反应生成的溶液含Fe2+、Fe3+,Fe3+遇KSCN溶液变为血红色;
(4)制取FeCl3•6H2O晶体,设计流程如下:滤液$\stackrel{物质A}{→}$FeCl3溶液→FeCl3•6H2O晶体,因滤液含Fe2+,物质A应具有氧化物,且不引入杂质,因铁离子水解生成的盐酸易挥发,加盐酸抑制水解,则蒸发浓缩、降温结晶、过滤可制备晶体,以此来解答.
解答 解:(1)装置B中发生反应的化学方程式是4H2O(g)+3Fe$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2,故答案为:4H2O(g)+3Fe$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2;
(2)装置D中碱石灰的作用是干燥氢气,故答案为:干燥;
(3)检验滤液中Fe3+的操作方法为取滤液置于试管中,加入几滴KSCN溶液,若溶液变为血红色,则说明有Fe3+,故答案为:取滤液置于试管中,加入几滴KSCN溶液,若溶液变为血红色,则说明有Fe3+;
(4)①物质A可以是过氧化氢或氯水气,其作用为使Fe2+转化为Fe3+,且不引入新杂质,故答案为:DE;使Fe2+转化为Fe3+;
②从FeCl3稀溶液到FeCl3•6H2O晶体的主要操作包括蒸发浓缩、降温结晶、过滤,该流程中需保持盐酸过量,主要原因是发生Fe3++3H2O?Fe(OH)3+3H+,过量的HCl可抑制Fe3+的水解,故答案为:发生Fe3++3H2O?Fe(OH)3+3H+,过量的HCl可抑制Fe3+的水解.
点评 本题考查物质的制备实验,为高频考点,把握制备实验装置及流程、物质的性质及发生的反应为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知X、Y、Z、M、G是五种短周期主族元素,且原子序数依次增大.X原子核内只有1个质子,Y的原子最外层电子数是其电子层数的2倍,Y与G同主族,Z的一种单质能吸收对人体有害的紫外线,M是地壳中含量最高的金属元素.请回答下列问题:
已知X、Y、Z、M、G是五种短周期主族元素,且原子序数依次增大.X原子核内只有1个质子,Y的原子最外层电子数是其电子层数的2倍,Y与G同主族,Z的一种单质能吸收对人体有害的紫外线,M是地壳中含量最高的金属元素.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a | ||
| b | ||
| c |
| A. | 氯、氟、硫 | B. | 氟、硫、砷 | C. | 氦、氟、氯 | D. | 氖、氯、硒 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,乙物质中含有的化学键是离子键、共价键;
,乙物质中含有的化学键是离子键、共价键; ,
,查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 纳米级Fe粉是新型材料,具有超强磁性、高效催化性.某化学小组探究用氢气和碳酸亚铁制取纳米级铁粉.其实验设计如图(加热、支持装置省略)
纳米级Fe粉是新型材料,具有超强磁性、高效催化性.某化学小组探究用氢气和碳酸亚铁制取纳米级铁粉.其实验设计如图(加热、支持装置省略)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑.
.写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
. .
. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com