
| A. | v(O2)=0.2mol/(L•s) | B. | v(SO3)=8mol/(L•min) | C. | v(SO2)=6mol/(L•min) | D. | v(O2)=6mol/(L•min) |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑤⑥ | C. | ①②④⑥ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 托盘两边各垫一张质量相等的纸片称取固体NaOH | |
| B. | 容量瓶内水分未干便注入了液体 | |
| C. | 洗涤刚才盛过溶质的烧杯的洗涤液没有转入容量瓶 | |
| D. | 定容后使溶液混匀,静止,发现凹液面低于刻度线,立即滴加蒸馏水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CO(g)═2C(s)+O2(g) | B. | NH4Cl(s)=NH3(g)+HCl(g) | ||
| C. | (NH4)2CO3(s)═NH4HCO3(s)+NH3(g) | D. | MgCO3(s)═MgO(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
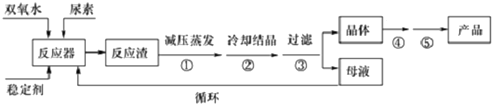
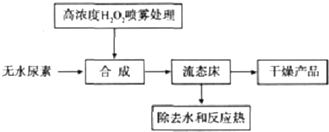
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
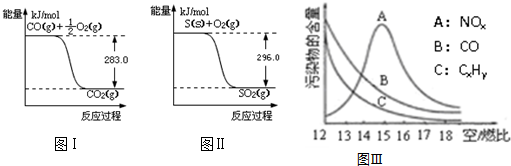
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com