
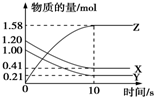
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.158 mol•L-1•s-1 | |
| B. | 反应开始到10 s时,平均反应速率:v(X)=v(Y)=0.039 5 mol•L-1•s-1 | |
| C. | 10 s后,该反应停止进行 | |
| D. | 反应的化学方程式为2X(g)+Y(g)?2Z(g) |
分析 根据图象的曲线变化判断物质的量的变化以及反应速率、转化率的计算,根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式.
解答 解:A.反应开始到10s,用Z表示的反应速率$\frac{\frac{1.58mol}{2L}}{10s}$=0.079mol/(L•s),故A错误;
B.反应开始到10s,X的物质的量浓度减少了$\frac{1.2mol-0.41mol}{2L}$=0.395mol/L,x、Y的物质的量变化量一样,二者表示的速率一样,所以v=$\frac{△c}{t}$=0.039 5 mol•L-1•s-1,故B正确;
C.10s后达到了平衡,该反应仍然进行,故C错误;
D.由图象可以看出,反应中x、Y的物质的量减少,应为反应物,z的物质的量增多,应为生成物,当反应进行到10s时,△n(X)=0.79mol,△n(Y)=0.79mol,△n(Z)=1.58mol,则△n(X):△n(Y):△n(Z)=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为X(g)+Y(g)?2Z(g),故D错误;
故选B.
点评 本题考查化学平衡图象问题,题目难度不大,解题时注意分析图象中各物理量的变化曲线,把握相关物理量的计算.


科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 81.5% | C. | 18.5% | D. | 21.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肼(N2H4)分子中只存在极性共价键 | |
| B. | 该反应中肼作还原剂 | |
| C. | 该反应的反应物总能量高于生成物的总能量 | |
| D. | 此情况下,液态肼燃烧生成1 mol N2时放出的热量为641.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
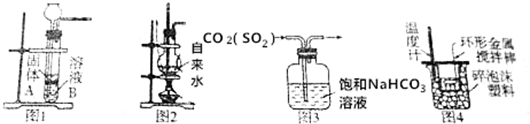
| A. | 用图1装置,若A为石灰石,B为稀硫酸,则可制取二氧化碳 | |
| B. | 用图2装置,若加上冷凝装置,可制取蒸馏水 | |
| C. | 用图3装置,可除去二氧化碳中的杂质二氧化硫 | |
| D. | 用图4装置,可测定中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生鸡蛋煮熟后,蛋白质发生变性,人食用后,酶不能发挥作用将蛋白质消化,因此生吃鸡蛋比熟吃好 | |
| B. | 登高山时防晒护目是为了防止紫外线引起皮肤和眼睛蛋白质被烧伤变性 | |
| C. | 温度越高,酶对某些化学反应的催化效率越高 | |
| D. | 毛巾、口罩经常用开水蒸煮,被褥放在太阳光下直射,其目的是使油脂水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁在干燥的环境中不易腐蚀 | |
| B. | 原电池工作时,电解质溶液中的阳离子移向正极 | |
| C. | 用铝质铆钉铆接铁板,铆接处的铁板更易被腐蚀 | |
| D. | 集中回收处理废旧电池的主要目的是防止电池中的重金属离子污染土壤和水源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com