
【题目】某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的气态物质。
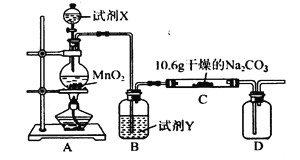
(1)装置A中发生反应的离子方程式为_______________________________________。
(2)装置B中试剂Y应为_________________。
(3)已知在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物),装置C中只有氯化钠和碳酸氢钠。若C中有0.1 mol Cl2参加反应,可推知C中反应生成的含氯氧化物为______________(写化学式)。
(4)该实验装置中明显存在不足之处,改进的措施为____________________________。
【答案】 MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O 饱和食盐水(或饱和氯化钠溶液) Cl2O 在装置D后连接一尾气处理装置(或连接一盛有NaOH溶液的洗气瓶)
Mn2++Cl2↑+2H2O 饱和食盐水(或饱和氯化钠溶液) Cl2O 在装置D后连接一尾气处理装置(或连接一盛有NaOH溶液的洗气瓶)
【解析】本题考查了物质性质验证的实验设计,步骤分析判断,现象分析理解,掌握物质性质和实验设计方法是解题关键。
(1)实验室制备氯气,结合装置分析可知是利用二氧化锰和浓盐酸加热反应生成氯气,反应的离子方程式为:MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O。 (2) 实验室制备氯气中含有氯化氢气体,需要用饱和食盐水除去。(3)C中有0.1mol氯气参加反应,装置C中通入一定量的氯气后,测得D中只有一种常温下黄红色的气体,反应为Cl2+Na2CO3→NaHCO3+NaCl+X,依据氧化还原反应电子守恒计算判断氯元素化合价为+1价,可推知C中反应生成的含氯氧化物为Cl2O。(4)实验过程中产生氯气是有毒气体,不能排放到空气中,而装置D后没有尾气吸收装置。
Mn2++Cl2↑+2H2O。 (2) 实验室制备氯气中含有氯化氢气体,需要用饱和食盐水除去。(3)C中有0.1mol氯气参加反应,装置C中通入一定量的氯气后,测得D中只有一种常温下黄红色的气体,反应为Cl2+Na2CO3→NaHCO3+NaCl+X,依据氧化还原反应电子守恒计算判断氯元素化合价为+1价,可推知C中反应生成的含氯氧化物为Cl2O。(4)实验过程中产生氯气是有毒气体,不能排放到空气中,而装置D后没有尾气吸收装置。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】当光束通过下列物质时,不会出现丁达尔效应的是( )
①氢氧化铁胶体 ②水 ③有尘埃的空气 ④蔗糖溶液 ⑤硫酸铜溶液
A.①②④B.①③⑤C.①③④D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
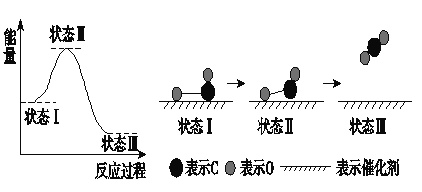
下列说法中正确的是( )
A. CO和O生成了具有共价键的CO2 B. 在该过程中,CO断键形成C和O
C. 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 D. CO和O生成CO2是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:下列说法正确的是( )

A. 滤液A中的阳离子为Fe3+、Fe2+、H+
B. 样品中CuO的质量为4.0 g
C. 样品中Fe元素的质量为2.24 g
D. V=896
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列与化学相关的说法正确的是 ( )
A.水泥、陶瓷、水晶均属于硅酸盐产品
B.医用酒精和Fe(OH)3胶体可用丁达尔效应区分
C.氯水和食盐水消毒杀菌的原理相同
D.盐酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是有关FeSO4的转化关系 (无关物质已略去)。

已知:①X由两种化合物组成,将X通入品红溶液,溶液退色;通入BaCl2溶液,产生白色沉淀。②Y是红棕色的化合物。
(1) 气体X的成分是(填化学式)________。
(2) 反应Ⅰ的反应类型属于(填序号)________。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3) 溶液2中金属阳离子的检验方法是____________________________________________。
(4) 若经反应Ⅰ得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅰ的化学方程式是_______________________________________________,
反应Ⅳ中生成FeSO4的离子方程式是_____________________________________________。
(5) 一瓶长期露置在空气中的FeSO4溶液,为检验其是否完全变质,则需要的试剂是___________(填写名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】180℃时将0.5 mol H2和1 mol CO2通入1 L的恒容密闭容器中,反应生成甲醇蒸汽(CH3OH)和某无机副产物,测得各物质的物质的量随时间的部分变化如图所示,下列说法中正确的是

A. 该反应的化学方程式:2CO2+4H2![]() 2CH3OH+O2
2CH3OH+O2
B. 在0~3 min内H2的平均化学反应速率为0.1 mol·L-1·min-1
C. 当容器内混合气体密度不再变化时,表明反应已经达到平衡状态
D. 在3~10 min内,反应仍未达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳气体可以用石灰石与稀盐酸反应制取,某同学在做该实验时,发现实验室中暂时没有稀盐酸,经过思考,他选择了稀硝酸。仅选择稀硝酸这一环节,该同学运用的方法是
A.实验法
B.比较法
C.观察法
D.分类法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com