
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
| ||
| ||


科目:高中化学 来源: 题型:
| A、标准状况下,0.56L丙烷中含有共价键的数目为0.2NA |
| B、常温常压下,6.4g氧气和臭氧中含有的分子总数为0.2NA |
| C、1mol羟基中电子数为10NA |
| D、0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2++Cl2═2Fe3++2Cl- |
| B、Fe(OH)3与氢溴酸溶液混合:Fe(OH)3+3HBr═Fe3++3Br-+3H2O |
| C、用氨水吸收烟道气中的SO2:SO2+2NH3?H2O═2NH4++SO32-+H2O |
| D、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、羟基乙酸(HOCH2COOH)的缩聚物: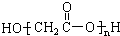 |
B、H2O2的分子结构模型示意图: |
| C、在CS2、PCl5中各原子最外层均能达到8电子的稳定结构 |
| D、淀粉和纤维素的实验式都为 CH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 转化的甲醇的物质的量 |
| 催化剂的物质的量 |
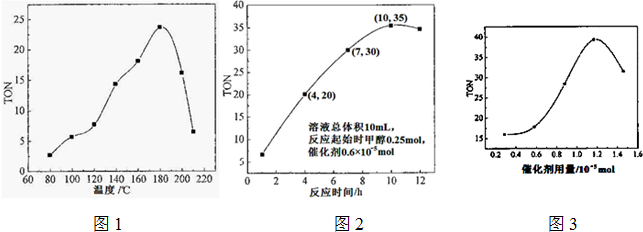
| H2CO3 |
| HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.
常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.查看答案和解析>>
科目:高中化学 来源: 题型:
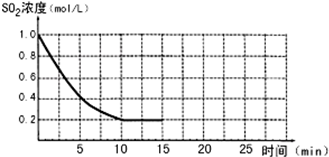 已知:2SO2(g)+O2(g)?2SO3(g);△H=-196kJ/mol,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图.
已知:2SO2(g)+O2(g)?2SO3(g);△H=-196kJ/mol,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图.查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
| A、若25<t1<t2,则a<1×10-14 |
| B、t2℃时,将一定物质的量浓度的盐酸与氢氧化钠溶液中和后,所得混合溶液pH=7,溶液呈中性 |
| C、25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,取该溶液1 mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1 |
| D、t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合,所得混合溶液的pH=2,则V1:V2=11:9(设混合后溶液的体积为原两溶液体积之和) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L CH3CHO中含有的分子数为NA |
| B、pH=1的稀硫酸中含有的H+数为0.1NA |
| C、7.80g Na2O2与5.85g NaCl所含阴离子数相等 |
| D、标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com