
| A. | 开始滴入NaOH溶液时立即产生白色沉淀 | |
| B. | 原固体混合物中镁的质量是1.2g | |
| C. | V=100mL | |
| D. | 若将5.1g该合金溶于足量的氢氧化钠溶液,在常温常压下放出3.36L气体 |
分析 A、B.最终得到5.8g沉淀为Mg(OH)2的质量,其物质的量为0.1mol,用镁原子守恒可知合金中Mg为0.1mol,可得合金Mg的质量,再计算合金中Al的物质的量,计算消耗HCl物质的量确定盐酸是否有剩余,进而判断反应后溶液中加入氢氧化钠溶液后是否立即生成白色沉淀;
C.VmL时沉淀质量达到最大值,此时溶液中溶质为NaCl,根据钠离子、氯离子守恒计算消耗NaOH物质的量,进而计算消耗NaOH溶液体积;
D.只有Al反应生成氢气,根据电子转移守恒可以计算生成氢气物质的量,但常温常压下气体摩尔体积不是22.4L/mol.
解答 解:A.最终得到5.8g沉淀为Mg(OH)2的质量,其物质的量为$\frac{5.8g}{58g/mol}$=0.1mol,用镁原子守恒可知合金中Mg为0.1mol,故合金中Mg的质量为0.1mol×24g/mol=2.4g,则合金中Al的物质的量为$\frac{5.1g-2.4g}{27g/mol}$=0.1mol,二者恰好反应消耗HCl为0.1mol×2+0.1mol×3=0.5mol<0.1L×6mol/L=0.6mol,故盐酸有剩余,则加入NaOH溶液后先中和剩余的HCl,可以没有白色沉淀产生,故A错误;
B.由A中分析可知,合金Mg的质量为2.4g,故B错误;
C.VmL时沉淀质量达到最大值,此时溶液中溶质为NaCl,根据钠离子、氯离子守恒:n(NaOH)=n(NaCl)=n(HCl)=0.6 mol,故消耗NaOH溶液体积为$\frac{0.6mol}{6mol/L}$=0.1L=100mL,故C正确;
D.只有Al反应生成氢气,根据电子转移守恒,可知生成氢气物质的量为$\frac{0.1mol×3}{2}$=0.15mol,若为标况下生成氢气体积为0.15mol×22.4L/mol=3.36L,但常温常压下气体摩尔体积不是22.4L/mol,故D错误.
故选:C.
点评 本题考查混合物有关计算,关键是明确发生的反应、确定盐酸是否有剩余,掌握守恒法在计算中应用,题目有利于考查学生分析计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 除去乙醇中微量水用金属钠 | |
| B. | 溴苯中混有溴,加入水萃取 | |
| C. | 用酸性高锰酸钾除去乙烷中的乙烯 | |
| D. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
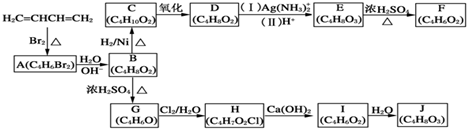
 +H2O,
+H2O,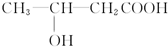 和
和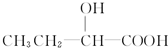 以外,还有
以外,还有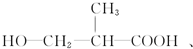 、
、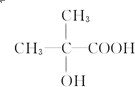 (写出结构简式,不考虑立体异构).
(写出结构简式,不考虑立体异构). ;
;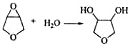 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
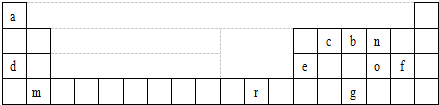
 ;
;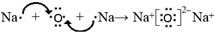 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合粉末中物质的量之间一定满足:n(Cu)+n(Fe)=n(Fe2O3) | |
| B. | 混合粉末中物质的量之间一定满足:n(Fe)>n(Cu)>n(Fe2O3) | |
| C. | 混合粉末中物质的量之间一定满足:n(Cu)+n(Fe)═n(Fe2O3)+$\frac{bL}{22.4L•mo{l}^{-1}}$ | |
| D. | 若a=72.50,b=1.12,则20.40g混合粉末中:n(Fe)=n(Cu)=0.05mol、n(Fe2O3)=0.09mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com