(2013?淄博二模)实验室模拟用工业废弃固体(含有Cu
2S、Al
2O
3、Fe
2O
3、SiO
2等)制取粗铜、绿矾(FeSO
4?7H
2O)和明矾[Kal(SO
4)
2?12H
2O]的操作流程如下:
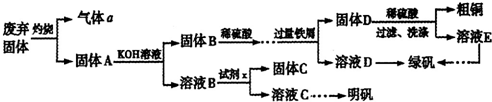
(1)试剂x是
H2SO4(或KHSO4)
H2SO4(或KHSO4)
(写化学式).
(2)配平下列方程式:
2
2
MnO
4-+
5
5
SO
2+
2
2
H
2O=Mn
2+5
5
SO
42-4
4
H
+(3)为了分析产品(绿矾)中铁元素的含量,某同学称取20.0g样品配成100mL溶液,移取25.00mL用1.000×10
-1mol?L
-1KMnO
4标准溶液进行滴定(MnO
4-被还原为Mn
2+).
请回答下列问题:
①滴定时,KmnO
4标准溶液应盛放在
酸式滴定管
酸式滴定管
(填仪器名称)中.
②若达到滴定终点消耗KmnO
4标准溶液体积为25.00mL,则该产品中铁元素的质量分数为
14%
14%
.




 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案