
| A. | 二氧化硫具有还原性,可用二氧化硫水溶液吸收溴蒸气 | |
| B. | 氢氟酸具有强酸性,可用氢氟酸蚀刻玻璃 | |
| C. | 氨气具有氧化性,可用浓氨水检验氯气管道是否泄漏 | |
| D. | SiO2的导电能力强,可用于制造通讯光缆 |
分析 A.根据二氧化硫具有还原性,能被溴水氧化;
B.根据氢氟酸是弱酸,能与二氧化硅反应;
C.根据氨水可以用来检验有毒气体氯气的泄漏,反应式为3Cl2+8NH3=N2+6NH4Cl来分析;
D.二氧化硅具有良好的导光性.
解答 A.二氧化硫具有还原性,能被溴水氧化:SO2+Br2+2H2O=H2SO4+2HBr,可用二氧化硫水溶液吸收溴蒸气,故A正确;
B.氢氟酸是弱酸,可用氢氟酸蚀刻玻璃:4HF+SiO2=SiF4↑+2H2O,故B错误;
C.氨水可以用来检验有毒气体氯气的泄漏,反应式为:3Cl2+8NH3=N2+6NH4Cl,氨气具有还原性,故C错误;
D.二氧化硅具有良好的导光性,则用于制造通讯光缆,故D错误;
故选A.
点评 本题主要考查了物质的性质,难度不大,注意相关知识的积累,其中二氧化硅具有良好的导光性,硅是半导体材料.


科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中通入少量二氧化碳:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | NaOH溶液中通入少量二氧化碳:2OH-+CO2═CO32-+H2O | |
| C. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | AlCl3溶液中加入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气通过灼热的CuO粉末 | B. | 将锌粒投入Cu(NO3)2溶液 | ||
| C. | CO高温下还原Fe2O3 | D. | 二氧化碳通过Na2O2粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 6:3:2 | D. | 2:3:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
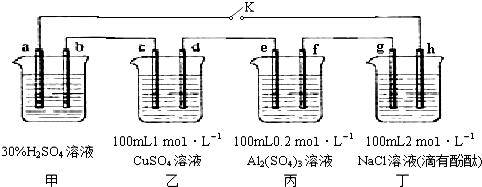
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| B. | 药皂中加入少量苯酚,可以起到杀菌消毒的作用 | |
| C. | 石油是混合物,其分馏产品汽油为纯净物 | |
| D. | 金属铝需经过特别处理才具有抗腐蚀能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲~庚元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断不正确的是( )
甲~庚元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断不正确的是( )| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚>己>戊 | |
| C. | 丁的氧化物可用于制造光导纤维 | |
| D. | 常温下,甲和乙的单质均能与水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
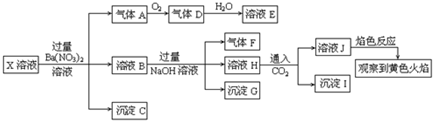
| A. | X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- | |
| B. | 气体F经催化氧化可直接生成气体D | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I可能有Al(OH )3 | |
| D. | X中不能确定的离子有Na+、K+和C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
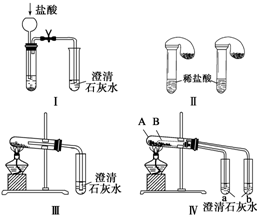
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com