
| A.Q1=Q3<Q2 | B.Q2>Q3>Q1 | C.Q3>Q2>Q1 | D.Q1=Q2=Q3 |
科目:高中化学 来源:不详 题型:填空题


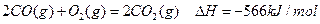
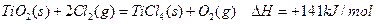
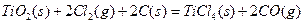 的
的 =________________。
=________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
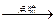 12CO2(g)+4CO(g)+18H2O(l)
12CO2(g)+4CO(g)+18H2O(l)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一Y | B.—(10X—Y) | C.一(5X—O.5Y) | D.+(10X—Y) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.是吸热反应 |
| B.是放热反应 |
| C.是熵减少的反应 |
| D.熵增大效应大于能量效应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.燃烧不一定要有氧气参加,但燃烧一定是放热反应 |
| B.化学反应中的能量变化都表现为热量变化 |
| C.为保证燃料充分燃烧,通入的空气要适当过量而不是越多越好 |
| D.为使液体燃料充分燃烧,可以将液体燃料喷成雾状,以保证燃料与空气有足够大的接触面积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在相同的条件下,2mol氢气与1mol氧气的总能量小于2mol水蒸气的总能量 | ||
B.H2(g)+
| ||
C.H2(g)+
| ||
| D.任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 a时,lmol H2完全燃烧生成液态水,放出2
a时,lmol H2完全燃烧生成液态水,放出2 85.8kJ的热量;1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3kJ的热量。下列热化学方程式书写正确的是 ( )
85.8kJ的热量;1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3kJ的热量。下列热化学方程式书写正确的是 ( )| A.2H2(g)+ O2(g)=2H2O(1);△H=-285.8kJ/mol |
B.CH4(g )+2 O2(g)=CO2(g)+2H2O(1);△H=-890.3kJ/mol )+2 O2(g)=CO2(g)+2H2O(1);△H=-890.3kJ/mol |
| C.CH4(g)+2 O2(g)=CO2(g)+2H2O(g);△H=-890.3kJ/mol |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(1);△H=+890.3kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com