
| 3 |
| 2 |
| 3 |
| 2 |


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
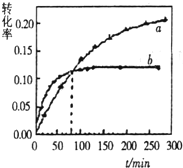 丙酮(CH3COCH3)在某溶剂里,在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq)取相同浓度的CH3COCH3,分别在40℃和60℃时,测得其转化率α随时间变化的关系曲线(α-t)如图所示.下列说法正确的是( )
丙酮(CH3COCH3)在某溶剂里,在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq)取相同浓度的CH3COCH3,分别在40℃和60℃时,测得其转化率α随时间变化的关系曲线(α-t)如图所示.下列说法正确的是( )| A、b代表40℃时CH3COCH3的α-t曲线 |
| B、升高温度可缩短该反应达平衡的时间并能提高平衡转化率 |
| C、增大压强可缩短该反应达平衡的时间并能提高平衡转化率 |
| D、上述反应的逆反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,金属钠可以成为绝缘体 |
| B、一定条件下,水在20℃时能凝固成固体 |
| C、用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒 |
| D、几千万年前地球上一条恐龙体内的某个原子可能在你的身体里 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ |
| C、①②③④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0.1 mol?L-1 NaOH溶液中:K+、Na+、SO42-、HCO3- |
| B、在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3- |
| C、在0.1 mol?L-1 FeCl3溶液中:K+、NH4+、I-、SCN- |
| D、在0.1 mol?L-1 Na2CO3溶液中:Al3+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、品红溶液中同时通入Cl2、SO2,漂白效果会更好 |
| B、加热可判断品红褪色是通入SO2还是通入Cl2引起的 |
| C、“无色化合物”分子中,19个碳原子都可能在同一平面上 |
| D、品红属于芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com