
【题目】如图X是直流电源。Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒。接通电路后,发现d附近显红色。

(1)①电源上b为___极
②Z槽中e为___极。
③连接Y、Z槽线路中,电子流动的方向是d___e(用“→”或“←”填空)。
(2)①写出Y槽中总反应的化学方程式:____。
②写出Z槽中e极上反应的电极反应式:___。
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。已知Cu2O+2H+=Cu+Cu2++H2O。回答下列相关问题:
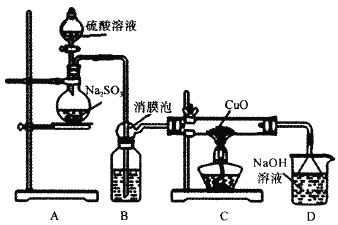
Ⅰ.SO2还原CuO的探究
(1)装置B中宜放入的试剂为___,消膜泡的作用是__。
(2)使用98%的H2SO4溶液制备SO2的速率明显小于使用65%的H2SO4溶液制备SO2,原因是__。
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈蓝色并仍有少量红色不溶物,由此可以得出SO2与CuO反应的方程式为__。
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取mg固体溶解于水配制为250mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-![]() I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。
①Na2S2O3标准溶液易变质,滴定前需要标定。配制该溶液时需要的玻璃仪器有烧杯、___、玻璃棒和试剂瓶。
②若消耗0.1000mol/LNa2S2O3标准溶液VmL,则产物中CuSO4质量分数为____(写表达式)。
③CuI沉淀物对I3-具有强的吸附能力,由此会造成CuSO4质量分数测定值____(填“偏大”或“偏小”)。为减少实验误差,滴定过程中,常常在接近终点时加入KSCN,使CuI转化为溶解度更小的CuSCN,该沉淀物对I3-吸附能力极弱,KSCN加入太早,I2的浓度较大,I2会将SCN-氧化生成SO42-和ICN,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了检验浓硫酸与木炭粉在加热条件下反应:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。产生的所有气体产物,选用了如图所示实验装置。
CO2↑+2SO2↑+2H2O。产生的所有气体产物,选用了如图所示实验装置。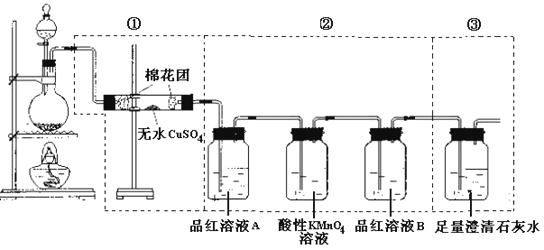
(1)①中无水硫酸铜的作用是___。
(2)②中酸性KMnO4溶液的作用是__。
(3)②中两次用到品红溶液,A的作用是___,B的作用分别是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。
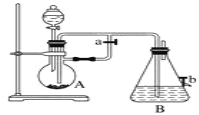
填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的是________,A中反应的离子方程式是________。
(2)实验开始时应先将活塞a打开,其目的是____________________。
(3)简述生成Fe(OH)2的操作过程:_______________________
(4)实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方程式为____。
(5)图中________(填“能”或“不能”)较长时间看到Fe(OH)2白色沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用电解硫酸钠溶液联合生产硫酸和烧碱,生产装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法中正确的是( )

A. a极与电源的负极相连
B. 产物丁为硫酸溶液
C. 离子交换膜d为阳离子交换膜
D. b电极反应式:4OH--4e- =O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中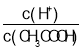 的比值将____________(填“增大”、“减小”或“无法确定”)。
的比值将____________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH甲________pH乙(填“大于”、“小于”或“等于”)。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为: V甲_____V乙(填“大于”、“小于”或“等于”)。
Ⅱ.有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
(1)该学生的操作是______________(填“正确的”或“不正确的”)。
(2)若用此法分别测定c (H+)相等的盐酸和醋酸溶液的pH,误差较大的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是_____,该错误操作会导致测定结果___________
(2)判断滴定终点的现象是:________________________________________
(3)如图是某次滴定时的滴定管中的液面,其读数为_______ mL。
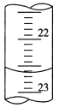
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复印机工作时易产生臭氧(O3),少量的臭氧有消毒空气之功效,但臭氧浓度过高时,对人的呼吸道、肺部有刺激。已知臭氧可发生如下反应:O3+2KI+H2O=2KOH+O2+I2,对该反应的下列说法不正确的是( )
A.KI发生的是氧化反应
B.O3是氧化剂,O3被还原生成的产物是KOH
C.氧化产物I2与还原产物O2的物质的量之比为1:1
D.H2O既不是氧化剂也不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2=H++HO2-,Ka=2.4×10-12)。下列说法错误的是( )

A.X膜为选择性阳离子交换膜
B.催化剂可促进反应中电子的转移
C.每生成1 mol H2O2电极上流过4 mol e-
D.b极上的电极反应为O2+H2O+2e-=HO2-+OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com