

分析 (1)依据仪器形状说出其名称;
(2)氯气具有强的氧化性,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝;
(3)氯气通过品红溶液,携带挥发出的水蒸气,要收集干燥氯气,需要除去氯气中水蒸气;
(4)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水.
解答 解:(1)图中仪器A为分液漏斗,故答案为:分液漏斗;
(2)氯气具有强的氧化性,能够氧化碘离子生成单质碘,离子方程式:Cl2+2I-=I2+2Cl-,碘遇到淀粉变蓝;
故答案为:溶液变蓝;Cl2+2I-=I2+2Cl-;
(3)浓硫酸具有吸水性,可以干燥氯气中的水蒸气,故答案为:浓硫酸;干燥氯气;
(4)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查了氯气的制备及氯气性质的检验、收集、尾气处理,明确制备原理及氯气的化学性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 阳极附近溶液呈红色 | B. | 阳极逸出气体 | ||
| C. | 阴极附近溶液呈蓝色 | D. | 溶液的PH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 正极 | Zn | Fe | 碳棒 | Cu |
| 负极 | 碳棒 | Zn | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | ZnCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
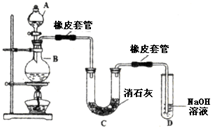 瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
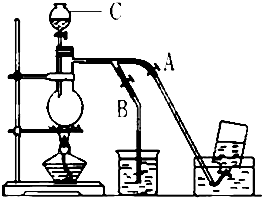 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
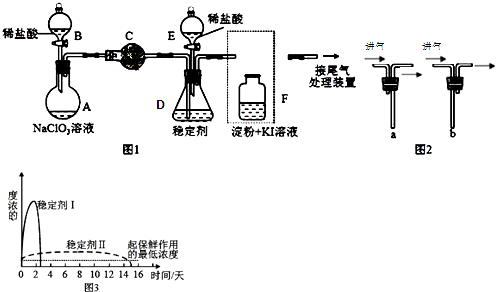
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 选项 | Ⅰ | Ⅱ | Ⅲ |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
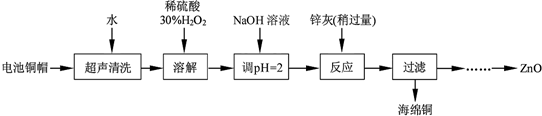
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.01mol•L-1Ba(OH)2溶液中:Na+、NH4+、NO3-、HCO3- | |
| B. | 使甲基橙变红色的溶液中:Mg2+、Fe2+、NO-3、Cl- | |
| C. | 含有苯酚的溶液中:K+、Cl-、Br-、Fe3+ | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、I-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com