
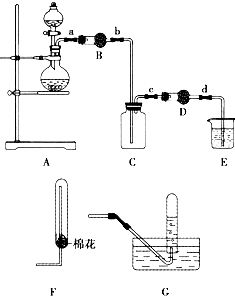
 某化学学习小组同学用下列装置制备、收集二氧化氮气体,并探究其性质(部分夹持装置已略去).
某化学学习小组同学用下列装置制备、收集二氧化氮气体,并探究其性质(部分夹持装置已略去).
|


科目:高中化学 来源:江苏省栟茶高级中学2009-2010学年高二年级学业水平测试模拟一(化学) 题型:058
某化学学习小组同学对实验室制取氨气和氨气的还原性等进行了以下探究,请你参与并完成对有关问题的解答.
[资料获悉]
①氨气与CuO反应的化学方程式:3CuO+2NH3![]() 3Cu+N2+3H2O
3Cu+N2+3H2O
②Cu2O粉末呈红色;Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+:Cu+![]() Cu+Cu2+.
Cu+Cu2+.
③在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2.
[实验设计]
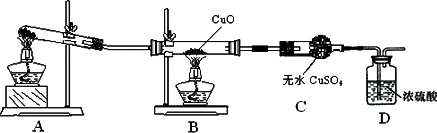
[实验探究]
(1)A装置是氨气的发生装置,则实验前大试管中应加入的药品是
________.(2)甲同学认为该实验设计有一定的缺陷,A装置产生的氨气中含有水蒸汽,影响了实验结论,应在A和B之间增加一个装有
________(填药品名称)的干燥装置.(3)利用改进后的装置进行实验,可观察到B装置中的现象为黑色固体变成红色,C装置中的现象为
________.[交流讨论]
(4)乙同学认为
NH3与CuO反应生成的红色物质中可能含有Cu2O(氧化亚铜).现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,则用最简便的实验方法证明红色固体中是否含有Cu2O所要选用的试剂是________.(5)丙同学认为可通过高温灼烧红色固体,并称量反应前后固体质量的变化来确定是否含有Cu2O.他先称干燥坩埚的质量为a g,再取红色固体置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,最后称得总质量为c g.
若确认红色固体中只含有Cu,则经高温灼烧后得到的物质是
________.若确认红色固体中含有Cu2O,则a、b、c应符合数学关系为
c<________.[拓展延伸]
(6)丁
同学认为利用上述实验设计改进后的装置还可测定Cu的相对原子质量,他是通过测定反应物CuO的质量和生成物H2O的质量来完成的,若实验测得完全反应的CuO和生成的H2O的质量分别为m(CuO)、m(H2O),则据此计算Cu的相对原子质量的代数式为________.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
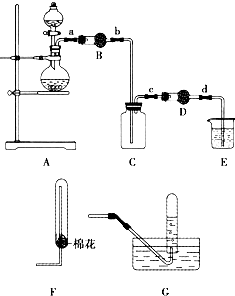 某化学学习小组同学用下列装置制备、收集二氧化氮气体,并探究其性质(部分夹持装置已略去).
某化学学习小组同学用下列装置制备、收集二氧化氮气体,并探究其性质(部分夹持装置已略去). □______+口NaNO2+□H2O.
□______+口NaNO2+□H2O.查看答案和解析>>
科目:高中化学 来源:期末题 题型:实验题
 3Cu+N2+3H2O
3Cu+N2+3H2O  Cu+Cu2+ 。
Cu+Cu2+ 。 
查看答案和解析>>
科目:高中化学 来源:期末题 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com