
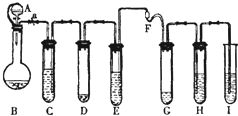
 “化学多米诺实验”即利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只需控制第一个反应,就好像多米诺骨牌游戏一样.如图是一个“化学多米诺实验”.各装置中试剂或物质:
“化学多米诺实验”即利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只需控制第一个反应,就好像多米诺骨牌游戏一样.如图是一个“化学多米诺实验”.各装置中试剂或物质:分析 (1)原电池原理的应用:形成原电池后可以加快负极金属的腐蚀速率;
(2)硫化氢具有还原性,可以被氧化为单质硫;
(3)硫化氢是一种有毒的酸性气体,要进行尾气处理;
(4)由于分液漏斗和烧瓶间有橡皮管相连,使分液漏斗中液面上方和烧瓶中液面上方的压强相同,无论装置是否漏气,都不影响分液漏斗中的液体滴入烧瓶.
解答 解:(1)在D装置中,锌和硫酸铜反应,生成的Cu、Zn、CuSO4溶液形成原电池,反应速率加快,
故答案为:<;锌和硫酸铜反应,生成的Cu、Zn、CuSO4溶液形成原电池,反应速率加快;
(2)硫化氢具有还原性,可以被氧化剂双氧水氧化为单质硫,是一种淡黄色的沉淀,
故答案为:有浅黄色沉淀生成;
(3)硫化氢是一种有毒的酸性气体,要用氢氧化钠溶液吸收H2S气体,I中发生的化学反应是:H2S+2NaOH═Na2S+2H2O,
故答案为:H2S+2NaOH═Na2S+2H2O;
(4)由于分液漏斗和烧瓶间有橡皮管相连,使分液漏斗中液面上方和烧瓶中液面上方的压强相同,无论装置是否漏气,都不影响分液漏斗中的液体滴入烧瓶,如检查是否漏气,应用止水夹夹住橡皮管,再观察分液漏斗中的液体是否能滴入烧瓶,如不能滴入,则说明不漏气.
故答案为:无法确定;由于分液漏斗和烧瓶间有橡胶管相连,使分液漏斗中液面上方和烧瓶中液面上方的压强相同,无论装置是否漏气,都不影响分液漏斗中的液体滴入烧瓶.
点评 本题是一道信息迁移题,考查学生分析和解决问题的能力,注意知识的积累是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 L pH=12的Ba(OH)2溶液中含有的OH-离子数为0.02 NA | |
| B. | 1L 0.1 mol•L-1的NaClO溶液中ClO-数目为0.1NA | |
| C. | 密闭容器中0.1 mol N2与0.3 mol H2一定条件进行反应,生成氨分子数目为0.2 NA | |
| D. | 标准状况下,2.24 L CO和CO2混合气体中含有的碳原子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔表示物质的质量的单位 | B. | 16gO2含有0.5mol O2分子 | ||
| C. | 2gH2的体积约为22.4L | D. | 物质的摩尔质量等于其式量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英玻璃、分子筛的主要成分是硅酸盐 | |
| B. | 分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液和胶体之间 | |
| C. | 铁在氧气中燃烧生成氧化铁,镁在空气中燃烧生成氧化镁、氮化镁 | |
| D. | 针对埃博拉病毒扩散情况,可选用含氯消毒剂对疫区可能的污染区域进行消毒预防 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
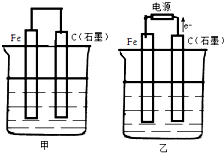 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
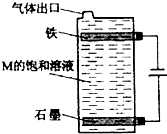 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质, .
.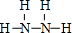 ;该物质与空气在碱性条件下可构成燃料电池,该电池放电时,负极的反应式为N2H4+4OH--4e-=N2↑+2H2O.
;该物质与空气在碱性条件下可构成燃料电池,该电池放电时,负极的反应式为N2H4+4OH--4e-=N2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
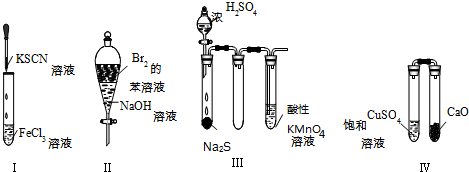
| A. | 实验Ⅰ:试管中溶液颜色变为红色 | |
| B. | 实验Ⅱ:振荡后静置,上层溶液颜色保持不变 | |
| C. | 实验Ⅲ:酸性KMnO4溶液中出现气泡,但颜色不会褪去 | |
| D. | 实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32- 可能存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{44}$mol-1 | B. | $\frac{x}{22}$mol-1 | C. | $\frac{3x}{44}$mol-1 | D. | $\frac{44x}{3}$mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com