
【题目】二碳化学的研究在工业生产中具有重要意义。
(1)在一定温度和压强下,已知:
化学键 | C—H | C—O | O—H | C=O | O=O | C—C |
键能(kJ·mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
①CH3CH2OH(g)+1/2O2(g)![]() CH3CHO(g)+H2O(g)△H1=____________。
CH3CHO(g)+H2O(g)△H1=____________。
②若2CH3CHO(g)+O2(g)![]() 2CH3COOH(g)反应可自发进行,
2CH3COOH(g)反应可自发进行,
则CH3CH2OH(g)+O2(g)![]() CH3COOH(g)+H2O(g)△H2_____0(填“>”、“<”或“=”)。
CH3COOH(g)+H2O(g)△H2_____0(填“>”、“<”或“=”)。
(2)将一定量CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g)![]() 2CH3CHO(g)+2H2O(g)至平衡状态。下列图像不合理的是_________。
2CH3CHO(g)+2H2O(g)至平衡状态。下列图像不合理的是_________。

(3)己知:25℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)= 1.75×10-5, ![]() ≈1.3,lgl.3≈0.1
≈1.3,lgl.3≈0.1
①25℃,0.lmol·L-1CH3COOH 溶液的pH =______;将0.1 mol·L-1CH3COOH溶液与0.1mol·L-1的氨水等体积混合,所得溶液中离子浓度大小关系为__________________。
②25℃,0.2 mol·L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=_____ (保留2位有效数字)。
③25℃,向0.1 mol·L-1氨水中加入少量NH4Cl固体,NH3·H2O![]() NH4+ + OH-的电离平衡_______(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质___________。
NH4+ + OH-的电离平衡_______(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质___________。
【答案】 203 kJ·mol-1 < B 2.9 c(CH3COO-)=c(NH4+)>c(H+)=c(OH-) 5.7×10-10 逆 取少量氨水于试管中,滴加2~3滴酚酞试液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅。证明NH3·H2O 是弱电解质(其它合理答案均可)
【解析】(1)①根据反应的焓变等于反应物的键能和减去生成的键能和可知:CH3CH2OH(g) +1/2 O2(g) ![]() CH3CHO(g)+ H2O(g) △H1=(414×5+332+464+326+498×
CH3CHO(g)+ H2O(g) △H1=(414×5+332+464+326+498×![]() )kJ·mol-1-(414×4+332+728+464×2)kJ·mol-1=203 kJ·mol-1 kJ·mol-1;
)kJ·mol-1-(414×4+332+728+464×2)kJ·mol-1=203 kJ·mol-1 kJ·mol-1;
②已知2CH3CHO(g) +O2(g) ![]() 2CH3COOH(g)的△S<0,若2CH3CHO(g) +O2(g)
2CH3COOH(g)的△S<0,若2CH3CHO(g) +O2(g) ![]() 2CH3COOH(g)反应可自发进行,则△G=△H2-T△S<0,故△H2<0;
2CH3COOH(g)反应可自发进行,则△G=△H2-T△S<0,故△H2<0;
(2 )A.气体的总质量不变,混合气体的体积增大,则密度先减小后不变,故A正确;B.气体的总质量不变,混合气体的总物质的最变大,平衡摩尔质量逐渐变小,最终不变,故B错误;C.随反应的进行,反应物的量逐渐减小,生成物的量逐渐增大,最终不变,故C正确;D.反应物的转化率未平衡前增大,平衡后不变,故D正确;答案为A。
(3)① 已知CH3COOH![]() CH3COO-+H+,25℃,0.lmol·L-1CH3COOH 溶液中Ka(CH3COOH)=[c(H+)×c(CH3COO-)]÷c(CH3COOH)=1.75×10-5,则c(H+)2=1.75×10-5÷c(CH3COOH)=1.75×10-5÷0.1mol/L=1.75×10-6,c(H+)=
CH3COO-+H+,25℃,0.lmol·L-1CH3COOH 溶液中Ka(CH3COOH)=[c(H+)×c(CH3COO-)]÷c(CH3COOH)=1.75×10-5,则c(H+)2=1.75×10-5÷c(CH3COOH)=1.75×10-5÷0.1mol/L=1.75×10-6,c(H+)=![]() ×10-3mol/L=1.3×10-3mol/L,此时溶液的pH=3-lg1.3=2.9;CH3COOH的电离能力和NH3·H2O相同,则CH3COO-和NH4+水解能力也相同,则CH3COONH4溶液显中性,等浓度等体积的CH3COOH溶液和的氨水混合恰好生成CH3COONH4,结合电荷守恒式c(CH3COO-)+c(OH-)=c(NH4+)+c(H+),所得溶液中离子浓度大小关系为 c(CH3COO-)=c(NH4+)>c(H+)=c(OH-);
×10-3mol/L=1.3×10-3mol/L,此时溶液的pH=3-lg1.3=2.9;CH3COOH的电离能力和NH3·H2O相同,则CH3COO-和NH4+水解能力也相同,则CH3COONH4溶液显中性,等浓度等体积的CH3COOH溶液和的氨水混合恰好生成CH3COONH4,结合电荷守恒式c(CH3COO-)+c(OH-)=c(NH4+)+c(H+),所得溶液中离子浓度大小关系为 c(CH3COO-)=c(NH4+)>c(H+)=c(OH-);
②已知NH4+ +H2O![]() NH3·H2O+H+,此时Kh=Kw÷Kb(NH3·H2O)=1×10-14÷1.75×10-5=5.7×10-10 ;
NH3·H2O+H+,此时Kh=Kw÷Kb(NH3·H2O)=1×10-14÷1.75×10-5=5.7×10-10 ;
③25℃,向0.1 mol·L-1氨水中加入少量NH4Cl固体,溶液中NH4+浓度增大,NH3·H2O![]() NH4+ + OH-的电离平衡逆向移;欲证明NH3·H2O是弱电解质,可取少量氨水于试管中,滴加2~3滴酚酞试液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅,即可证明NH3·H2O 是弱电解质。
NH4+ + OH-的电离平衡逆向移;欲证明NH3·H2O是弱电解质,可取少量氨水于试管中,滴加2~3滴酚酞试液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅,即可证明NH3·H2O 是弱电解质。


科目:高中化学 来源: 题型:
【题目】配制0.1molL﹣1NaCl溶液,下列操作会导致所配溶液的物质的量浓度偏高的是( )
A.称量时,左盘低,右盘高 B.定容时俯视读取刻度
C.原容量瓶洗净后未干燥 D.定容时液面超过了刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol/L的盐酸,测得溶液中CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )
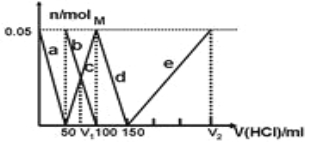
A.a曲线表示的离子方程式为AlO2-+H++H2O==Al(OH)3↓
B.原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
C.V1∶V2=l∶5
D.M点时生成的CO2为0.05 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.铬单质硬度大,耐腐蚀,是重要的合金材料。
(1)基态铬原子的价电子轨道表示式为________________;CrO2Cl2常温下为深红色液体,能与CCl4互溶,据此判断CrO2Cl2的晶体类型属于_________________。
(2)配合物CrCl3·6H2O的配位数为6,它有三种不同组成、不同颜色的固体,其中一种为浅绿色固体,该固体与足量硝酸银溶液反应时,0.5mol固体可生成1mol氯化银沉淀,则这种浅绿色固体的配体个数比(Cl-:H2O)为_____________。
II.砷化镓为第三代半导体材料,晶胞结构如图所示:
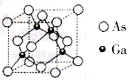
(3)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的化学方程式为__________。
(4)AsH3分子的立体构型为__________,其中As原子的杂化方式是______。1个(CH3)3Ga分子中含有_________个σ键,砷的第一电离能_______(填“>”或“<”)镓的第一电离能。
(5)砷化镓晶休中砷和镓的最近原子核间距为a nm,砷化镓的摩尔质量为bg·mol-1,阿伏加德罗常数值为NA,则砷化镓晶体的密度表达式是_____________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化是一种生产生活方式。下列行为与“绿色化”理念不相符的是
A. 大力发展清洁能源,减少对传统能源的依赖
B. 生活垃圾分类收集处理,实现资源化再利用
C. 大量生产和贮存石灰,修复酸雨浸蚀的土壤
D. 推广共享单车,倡导低碳、环保的出行方式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g),反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2,Y的百分含量与时间的关系如图2所示。下列分析不正确的是( )
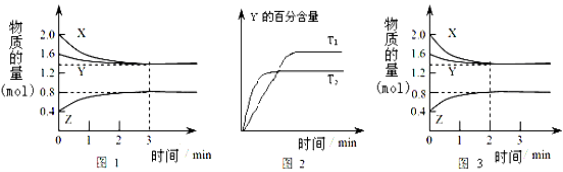
A.容器中发生的反应可表示为:3X(g)+Y(g)2Z(g)
B. 0~3min内,v(X)=0.1 mol/(Lmin)
C.若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强
D.达平衡后,升高温度,v正、v逆都增大,且再次平衡前v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1nm~100nm的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀的分散到蒸馏水中,得到的物质:①是溶液②是胶体③具有丁达尔现象④具有吸附性⑤浊液。其中正确的是( )
A.②③④ B.②③⑤ C.①④⑥ D.①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL 0.1mol/LH2R(二元弱酸)溶液中滴加0.1mol/LNaOH溶液,溶液pH与加入NaOH溶液体积的关系如图所示。下列有关说法正确的是
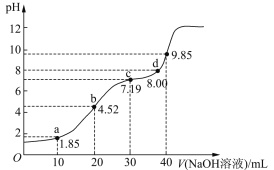
A. a点所示溶液中:c (H2R) + c (HR-)+ c (R2-)=0.lmol/L
B. b点所示溶液中:c (Na+) >c(HR-)> c (H2R)>c(R2-)
C. 对应溶液的导电性:b > c
D. a、b、c、d中,d点所示溶液中水的电离程度最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com