
下列变化规律不属于元素性质周期性变化规律的是( )
|
| A. | 第二周期N、O、F单质的沸点依次升高 |
|
| B. | 第三周期的P、S、Cl的氢化物的稳定性依次增强 |
|
| C. | 第三周期的P、S、Cl的最高价含氧酸的酸性依次增强 |
|
| D. | 第三周期的Na、Mg、Al的最高价氧化物的水化物的碱性依次减弱 |
| 元素周期表的结构及其应用;元素周期律和元素周期表的综合应用. | |
| 专题: | 元素周期律与元素周期表专题. |
| 分析: | 元素周期表中,同周期元素从左到右元素的金属性逐渐减弱,非金属性逐渐增强,对应氢化物的稳定性逐渐增强,最高价含氧酸的酸性增强,碱性减弱,以此解答. |
| 解答: | 解:A.第二周期N、O、F单质的沸点依次升高,与单质的分子间作用力有关,但不属于元素性质周期性变化规律,故A选; B.非金属性P<S<Cl,元素的非金属性越强,对应的氢化物越稳定,故B不选; C.非金属性P<S<Cl,元素的非金属性越强,对应的最高价含氧酸的酸性逐渐增强,故C不选; D.金属性Na>Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故D不选. 故选A. |
| 点评: | 本题考查元素周期律知识,为高频考点,题目难度不大,注意元素周期表和元素周期律的关系,原子核外电子呈现周期性的变化,元素的性质呈周期性变化. |


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
已知:A、B为常见的非金属单质且均为气体;甲、乙为金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性。各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):
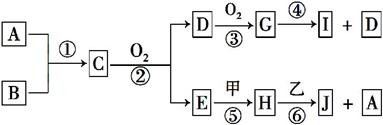
(1)写出反应②的化学方程式 。
(2)反应④中每消耗1 mol G,转移电子的物质的量为 。
(3)反应⑥的离子方程式是 。
(4)实验室中保存I的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A,它的氧化产物甲和还原产物乙都能和金属钠反应放出H2.甲和乙反应可生成丙,甲和丙均能发生银镜反应.有机物A是( )
|
| A. | 甲醇 | B. | 甲醛 | C. | 甲酸 | D. | 甲酸甲酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物H是一种香料,存在于金橘中,可用如下路线合成:
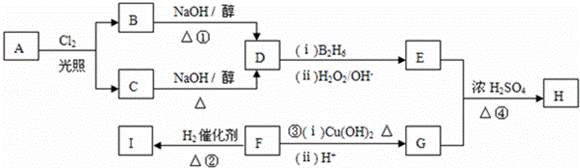
已知: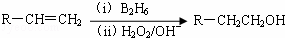 (B2H6为乙硼烷)
(B2H6为乙硼烷)
回答下列问题:
(1)0.1mol烃A在氧气中充分燃烧可以产生8.96L CO2(标准状况下)和9.0g H2O.A的分子式是 .
(2)反应①和④的反应类型是 、
(3)B和C均为一氯代烃,B的核磁共振氢谱显示只有一种化学环境的氢原子,则B的结构简式为 ,D的系统命名的名称为 .
(4)在催化剂存在下1mol F与2mol H2反应,生成I( ).F的结构简式是 .
).F的结构简式是 .
(5)反应③(ⅰ)的化学方程式为 .反应④的化学方程式为 .
(6)写出所有与G具有相同官能团的G的芳香类同分异构体的结构简式: 、、、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应从理论上分析不能将化学能转化为电能的是( )
|
| A. | NaAlO2+4HCl=NaCl+AlCl3+2H2O |
|
| B. | Mg+H2SO4=MgSO4+H2↑ |
|
| C. | 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
|
| D. | CH4+2O2=CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下2L的密闭容器中发生反应:2X(g)+3Y(g)⇌2Z(g),测得X、Y、Z的浓度分别为0.2mol/L、0.3mol/L、0.4mol/L,再经过10分钟时反应达到平衡状态,下列结论不正确的是( )
|
| A. | 若起始时加入容器的只有反应物X、Y,则起始加入的X、Y的物质的量之比一定是2:3 |
|
| B. | 若起始时加入容器的有X、Y、Z,则起始时加入的X、Y的物质的量之比一定是2:3,而Z的物质的量一定小于1.2mol |
|
| C. | 达到平衡状态时,Z的浓度可能是0.1mol/L也可能是0.6mol/L |
|
| D. | 达到平衡状态时,X的浓度可能是0.1mol/L也可能是0.4moL/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
中学阶段介绍的应用电解法制备的物质主要有三种:一是铝的工业制备、二是氯碱工业、三是金属钠的制备.下列关于这三个工业生产的描述中正确的是( )
|
| A. | 电解法制金属钠时,负极反应式:Na++e﹣=Na, |
|
| B. | 电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性 |
|
| C. | 在氯碱工业中,电解池中的阴极产生的是 H2,NaOH 在阳极附近产生 |
|
| D. | 氯碱工业和金属钠的冶炼都用到了NaCl,在电解时它们的阴极都是 C1一失电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
只用一种试剂来鉴别NaOH、Ba(OH)2、稀盐酸三种溶液,这种试剂是( )
|
| A. | 硫酸钠溶液 | B. | 氯化镁溶液 | C. | 碳酸钠溶液 | D. | 硝酸银溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com