
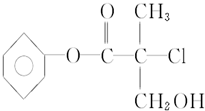
 某有机物X是农药生产中的一种中间体,其结构简式如图:
某有机物X是农药生产中的一种中间体,其结构简式如图: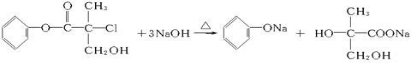 +NaCl+H2O.
+NaCl+H2O.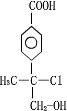 .
.分析 (1)根据有机物结构简式判断含有的元素种类和原子个数,可确定有机物分子式;
(2)根据结构简式判断官能团种类;
(3)根据含有的官能团判断有机物可能具有的性质;
(4)分子中含有酯基和氯原子,都可与氢氧化钠反应;
(5)遇氯化铁溶液不变色,但遇pH试纸显红色,说明不含酚羟基,但含有羧基.
解答 解:(1)由结构简式可知有机物的分子式为C10H11O3Cl,故答案为:C10H11O3Cl;
(2)由结构简式可知含有的官能团有酯基、羟基和氯原子,故答案为:酯基、羟基和氯原子;
(3)A.分子中含有氯原子,且邻位碳原子上有氢原子,可在氢氧化钠的醇溶液中发生消去反应,故A正确;
B.分子中含有羟基,可被氧化物醛基,故B正确;
C.由于羟基邻位碳原子没有氢原子,可不能发生消去反应,故C错误;
D.该物质在铁作催化剂时,可跟液溴发生取代反应,故D正确.
故答案为:ABD;
(4)与足量NaOH溶液反应为: +NaCl+H2O,
+NaCl+H2O,
故答案为: +NaCl+H2O;
+NaCl+H2O;
(5)遇氯化铁溶液不变色,但遇pH试纸显红色,说明不含酚羟基,但含有羧基,可能的结构为 ,故答案为:
,故答案为: .
.
点评 该题是高考中的常见题型,属于中等难度的试题.试题基础性强,侧重考查学生分析问题、解决问题的能力.该题的关键是准确判断出分子中含有的官能团,然后在根据相应官能团的结构和性质,灵活分析、判断即可.该题有利于培养学生严谨的逻辑思维能力和发散思维能力.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢气与氯气反应生成2mol氯化氢气体,需要释放183kJ的热量 | |
| B. | 氢气与氯气反应生成2mol氯化氢气体,需要吸收183kJ的热量 | |
| C. | 氢气与氯气反应生成1mol氯化氢气体,需要吸收183kJ的热量 | |
| D. | 氢气与氯气反应生成1mol氯化氢气体,需要释放183kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 装碱液的锥形瓶用NaOH溶液润洗 | |
| B. | 滴定时,眼睛注视酸式滴定管中液面的下降情况 | |
| C. | 应用右手控制酸式滴定管的活塞 | |
| D. | 若用甲基橙作指示剂,到滴定终点时锥形瓶内液体为橙色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和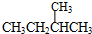 ;
;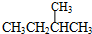 和
和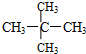 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.500 mol | B. | 1.00 mol | C. | 0.125mol | D. | 0.25 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化铝溶液中滴加过量的氨水:4NH3•H2O+Al3+═AlO2-+4NH4++2H2O | |
| B. | NH4Al(SO4)2溶液中滴加少量NaOH溶液:Al3++NH4++4OH-=Al(OH)3↓+NH3•H2O | |
| C. | 向明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| D. | 向NaAlO2溶液中通入足量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com