
| A. | 聚乙烯是通过加聚反应生成的 | |
| B. | 聚乙烯具有固定的元素组成,因而具有固定的熔、沸点 | |
| C. | 聚乙烯塑料袋因有毒,不可以装食品 | |
| D. | 聚乙烯因性质稳定,故不易造成污染 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某次酸雨的pH为4.3,是由于溶解了CO2 | |
| B. | 生铁、不锈钢、青铜都属于合金 | |
| C. | 汽车尾气不会引起呼吸道疾病 | |
| D. | 普通玻璃的主要成分是纯碱、石灰石和石英 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
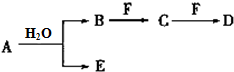 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题: ;D中所含化学键的类型离子键、共价键.
;D中所含化学键的类型离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,pH=13的NaOH溶液中含有OH-为0.1NA | |
| B. | 一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1NA | |
| C. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| D. | 78 g Na2O2与足量的H2O反应,电子转移个数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com