
| A. | 油脂的水解反应又叫皂化反应 | |
| B. | 分子式为C5H12O的醇类有5种结构 | |
| C. | 乙醇发生氧化反应生成乙酸,乙酸和乙醇发生取代反应生成乙酸乙酯 | |
| D. | 有机物甲的分子式为C3H6,则甲与乙烯(C2H4)互为同系物 |
分析 A.油脂在碱性条件下的水解为皂化反应;
B.先书写戊基-C5H11异构体,戊基异构数目等于戊醇的异构体数目;
C.乙醇含有羟基,可发生氧化反应和酯化反应;
D.分子式为C3H6的有机物可能为丙烯和环丙烷.
解答 解:A.肥皂的主要成分为高级脂肪酸钠,在碱性条件下生成,则油脂在碱性条件下的水解为皂化反应,故A错误;
B.戊基-C5H11可能的结构有:-CH2CH2CH2CH2CH3、-CH(CH3)CH2CH2CH3、-CH(CH2CH3)2、-CHCH(CH3)CH2CH3、-C(CH3)2CH2CH3、-C(CH3)CH(CH3)2、-CH2CH2CH(CH3)2、-CH2C(CH3)3,则戊醇的可能结构有8种,故B错误;
C.乙醇含有羟基,可发生氧化反应生成乙酸,二者发生酯化反应生成乙酸乙酯,也为取代反应,故C正确;
D.分子式为C3H6的有机物可能为丙烯和环丙烷,二者不一定为同系物,故D错误.
故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把握有机物的结构和官能团的性质,本题注意同分异构体的判断,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| c(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
| A. | 容器甲中的反应在前2min的平均速率v(SO2)=0.05mol•L-1•min-1 | |
| B. | 达到平衡时,容器丙中正反应速率与容器甲相等 | |
| C. | 温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0 | |
| D. | 容器乙中若起始时改充0.10mol•L-1NO2和0.20mol•L-1SO2,达到平衡时c(NO)与原平衡不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 3:2:2 | C. | 1:2:3 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
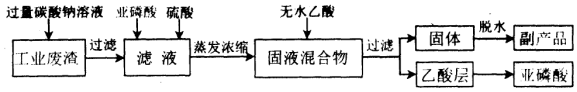
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2Cl2的结构式为Cl-S-S-Cl | |
| B. | S2Cl2中S原子的杂化类型为sp2杂化 | |
| C. | S2Cl2分子中各原子核外最外层电子均达到8电子稳定结构 | |
| D. | S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铵态氮肥和草木灰适宜混合使用 | |
| B. | 75%的酒精溶液可用作皮肤消毒剂 | |
| C. | SO2可用于漂白银耳 | |
| D. | 油脂和纤维素均可为人体提供能量. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫可用于杀菌、消毒 | |
| B. | 煤经过气化和液化等物理变化可转化为清洁能源 | |
| C. | 氯气和明矾均可做自来水的消毒剂 | |
| D. | 食品保鲜剂中所含铁粉和生石灰均作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
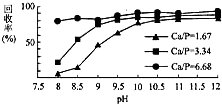 三氯氧磷(POCl3)常温下为无色液体,有广泛应用,近年来,三氯氧磷的工业生产由三氧化磷的“氯气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).
三氯氧磷(POCl3)常温下为无色液体,有广泛应用,近年来,三氯氧磷的工业生产由三氧化磷的“氯气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com