
【题目】下列关于化学键说法正确的是( )
A.构成单质分子的微粒中不一定含有化学键
B.只含有共价键的物质一定是共价化合物
C.NaCl溶于水破坏了离子键,乙醇溶于水破坏了共价键
D.CaCl2 中既有共价键又有离子键
科目:高中化学 来源: 题型:
【题目】新合成的一种烃,其碳骨架呈三棱柱体(如图所示,碳碳键键长相等)。

(1)写出该烃的分子式__________。
(2)该烃的一氯代物是否有同分异构体_______________ 。
(3)该烃的四氯代物有多少种同分异构体____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知:![]()
![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开2 mol H—I键所需能量约为(c+b+a)kJ
C. 断开1 mol H—H键和1 mol I—I键所需能量大于断开2 mol H—I键所需能量
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=13的无色溶液中,下列各组离子能大量共存的是
A. K+、Na+、HCO3-、NO3- B. Na+、NH4+、NO3-、Cl-
C. K+、Na+、NO3-、Br- D. K+、Cu2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、锌、镍、铬及其合金在现代社会中的用途越来越广泛。
(1)铁在元素周期表中的位置是_____________,基态铁原子有_________种不同运动状态的电子。
(2)镍可与CO形成配合物Ni(CO)n,CO分子中σ键与π键的个数比为________;该配合物中原子Ni的价层电子总数为18,则n=________,该配合物的熔点是170℃,则Ni(CO)n 属于__________
(3)在铬的摧化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是______,乙醛分子中H—C=O的键角_______(填“大于”、“等于”或“小于”)乙醇分子中的H—C—O的键角。乙醇和乙醛均极易溶于水,其主要原因是_______________。
(4)立方NiO晶体结构类似于NaCl,则Ni2+填入O2-构成的________空隙(填“正四面体”、“正八面体”、“立方体”或“压扁八面体”)。其晶胞边长为ɑ pm,列式表示NiO晶体的密度为____g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. S的摩尔质量是32g B. 1mol12C的质量是6g
C. 1molO2 的质量是32g/mol D. Fe2+摩尔质量是56g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是( )
A. T2时,NO2的平衡转化率为70.0%
B. 该反应的△H>0、T1<T2
C. 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的H+(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(烃基自由基)。下列说法错误的是

A. 无论是否鼓入空气,负极的电极反应式均为Fe-2e-=Fe2+
B. 不鼓入空气时,正极的电极反应式为H++e-=H·
C. 鼓入空气时,每生成1mol·OH有2mol电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又是电动公交车的清洁能源,利用水煤气在一定条件下含成甲醇,发生的反应为:CO (g) +2H2(g)![]() CH3OH(l) △H=?
CH3OH(l) △H=?
(1)己知CO、H2、CH3OH的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol 则△H=______。
(2)在一容积为2L的恒容密闭容器中加入0.2mol CO和0.4mol H2,发生如下反应:CO (g) +2H2(g)![]() CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
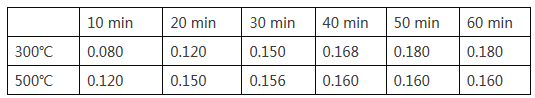
①由上述数据可以判断:T1℃_____T2℃
②T1℃时,0~20minH2的平均反应速率v(H2)=_________。
③该反应T1℃达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是_____(选填编号)。
A.改用高效催化剂 B.升高温度 C.缩小容器体积 D.分离出甲醇 E.增加CO的浓度
(3)若保持T1℃不变,起始时加入CO、H2、CH3OH的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件___________。
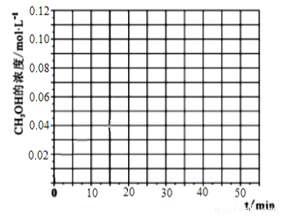
(4)当反应在T1℃达到20min时,控制体积不变,迅速将0.02molCO,0.04molH2,0.18molCH3OH同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出2040min内容器中 H2浓度的变化趋势曲线:___________
(5)在以CH3OH(l)为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为__________;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com