
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol•L-1]:c(Na+)>c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
分析 A.HCO3-的水解程度大于其电离程度,则:c(H2CO3)>c(CO32-);
B.根据碳酸钠溶液中的质子守恒进行判断;
C.CH3COONa和CH3COOH混合溶液pH=7,显示中性:c(H+)=c(OH-),再结合据电荷守恒判断;
D.反应后溶质为等浓度的碳酸钠和碳酸氢钠,碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-).
解答 解:A.NaHCO3溶液中,HCO3-的水解程度大于其电离程度,溶液呈碱性:c(OH-)>c(H+)、c(H2CO3)>c(CO32-),则溶液中各粒子浓度大小为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故A错误;
B.在0.1 mol•L-1Na2CO3溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),整理可得:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故B正确;
C.CH3COONa和CH3COOH混合溶液pH=7,则c(H+)=c(OH-),根据电荷守恒可得:c(Na+)=c(CH3COO-),正确的离子浓度大小为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故C错误;
D.0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液,反应后溶液中溶质为等浓度的碳酸钠和碳酸氢钠,碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-),正确的离子浓度大小为:c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故D错误;
故选B.
点评 本题考查离子浓度大小比较,题目难度中等,涉及盐的水解原理的应用、离子浓度大小比较、酸碱混合的定性判断等知识,明确电荷守恒、物料守恒以及质子守恒的应用是解答关键.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
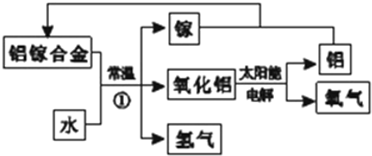 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +H2O(未配平)下列有关三聚氰酸的说法不正确的是( )
+H2O(未配平)下列有关三聚氰酸的说法不正确的是( )| A. | 分子式为C3H3N3O3 | |
| B. | 分子中只含极性键,不含非极性键 | |
| C. | 属于共价化合物 | |
| D. | 该分子中的N原子采用sp杂化、C原子采用sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H5CH2CH=M | B. | CH2=CH2 | ||
| C. | C6H5CH2CH2C6H5 | D. | C6H5CH2CH=CHCH2C6H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SiO3<H3PO4<H2SO4 | B. | 电负性:I>Cl>Br>F | ||
| C. | 第一电离能:N>O>C | D. | 沸点:H2O>H2Te>H2Se>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
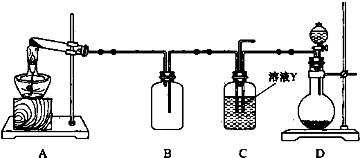
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “钡餐”中使用的硫酸钡是弱电解质 | |
| B. | 镀锌铁镀层破损后,铁更容易被腐蚀 | |
| C. | 提倡人们购物时不用塑料袋,是为了防止白色污染 | |
| D. | 推广使用太阳能、风能、海洋能、氢能,不利于缓解温室效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com