


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
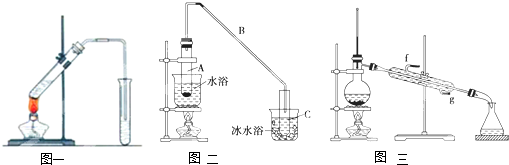
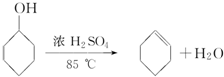
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
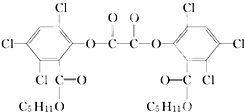 夏日的夜晚,常看见儿童手持发光的“魔棒”在广场上嬉戏.“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列有关说法不正确的是( )
夏日的夜晚,常看见儿童手持发光的“魔棒”在广场上嬉戏.“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列有关说法不正确的是( )| A、草酸二酯的分子式为C26H24Cl6O8 |
| B、1 mol草酸二酯与氢氧化钠稀溶液反应(苯环上卤素不水解),最多消耗4 mol NaOH |
| C、该有机物能发生加成反应、取代反应、氧化反应 |
| D、1 mol草酸二酯与氢气完全反应,需要氢气6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCN溶液 |
| B、HF溶液 |
| C、CH3COOH溶液 |
| D、HNO2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 |
| B、放电时正极反应为:2FeO42-+6e-+8H2O═2Fe(OH)3+10OH- |
| C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化 |
| D、放电时正极附近溶液的碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取羊皮纸袋内液体加入碘水变蓝色 |
| B、取烧杯中液体加入KI溶液不变蓝色 |
| C、取烧杯中液体加入AgNO3溶液产生黄色沉淀 |
| D、取烧杯中液体加入碘水变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使pH试纸变红的溶液中:CO32-、Ba2+、Cl-、Na+ | ||
| B、由水电离产生的c(OH-)=1×10-10 mol/L的溶液中:NO3-、Mg2+、SO42-、Fe2+ | ||
C、在
| ||
| D、无色透明溶液中:Al3+、HCO3-、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、⑥②③⑤⑦④① |
| B、①④⑦③⑤②⑥ |
| C、①④⑤③⑦②⑥ |
| D、①④⑦⑤③②⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com