


科目:高中化学 来源:不详 题型:单选题
| A.0.3mol HNO3 | B.3.612×1023个HNO3分子 |
| C.0.1molH3PO4 | D.0.2molCH4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4 g重水(D2O)中所含质子数为0.2×6.02×1023 |
| B.4.48 L N2与CO的混合物所含分子数为0.2×6.02×1023 |
| C.6.2 g白磷与红磷的混合物中所含磷原子数为0.2×6.02×1023 |
| D.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 MnO4- +
MnO4- + H2O2 +
H2O2 + H+ ═
H+ ═ Mn2+ +
Mn2+ + O2 +
O2 +  H2O
H2O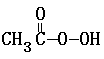 + 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O
+ 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O MnO4- +
MnO4- + H2O2 +
H2O2 + H+ ═
H+ ═  Mn2++
Mn2++  O2 +
O2 +  H2O
H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,11.2L氦气所含的原子数为NA |
| B.1.6gNH2-离子中所含的电子数为NA |
| C.常温常压下,44g二氧化碳分子中所形成的共用电子对数为2NA |
| D.NA个氮分子和NA个氢分子的体积比是1︰1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温常压下4.6g NO2和N2O4混合气体所含原子总数为0.3NA |
| B.标准状况下,22.4L SO3的分子数为NA |
| C.将标准状况下11.2L的Cl2通入足量水中发生反应,转移的电子总数为0.5NA |
| D.电解58.5 g熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,1.12L的SO3所含的原子数约为0.2NA |
| B.1 mol Na2O2中所含的阴离子数约为2NA |
| C.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA |
| D.5.6 g铁粉与硝酸反应失去的电子数一定为0.3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com