
分析 溶液中一定满足电荷守恒:c (Na+)+c (NH4+)+c (H+)酸+c (H+)水=c (OH-)水+c(Cl-)+2c (SO42-),由于溶液显酸性,则c (OH-)水很小,且c (H+)水=c (OH-)水,即由水电离出来的氢离子和氢氧根离子的数目相等,故可以略去不计,据此代入数据计算即可.
解答 解:溶液中存在电荷守恒:c (Na+)+c (NH4+)+c (H+)酸+c (H+)水=c (OH-)水+c(Cl-)+2c (SO42-),
由于溶液显酸性,则c (OH-)水很小,且c (H+)水=c (OH-)水,即由水电离出来的氢离子和氢氧根离子的数目相等,故可以略去不计,
代入数据有:5.0×10-5mol•L-1+1.0×10-6mol•L-1+c (H+)=7.1×10-5mol•L-1+2×4.5×10-6mol•L-1,
解得:c(H+)=2.9×10-5mol•L-1,
答:雨水中氢离子的物质的量浓度是2.9×10-5mol•L-1.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确电荷守恒的含义及应用方法为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
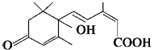 分子式为C15H20O4;
分子式为C15H20O4; 分子式C11H16
分子式C11H16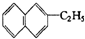 属于萘的同系物,则萘和萘的同系物分子组成通式CnH2n-12(n≥10)
属于萘的同系物,则萘和萘的同系物分子组成通式CnH2n-12(n≥10)
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将过量的Zn投入一定量的浓H2SO4中,最终生成的气体只有SO2 | |
| B. | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | |
| C. | 向50mL12mol•L-1的浓硝酸中加入足量铜片其充分反应,生成0.3molNO2 | |
| D. | 运输保存浓硫酸的槽罐车一旦泄露后应立即用大量水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极:2H++2e-═H2↑ 阳极:4OH--4e-═O2↑+2H2O | |
| B. | 阴极:Cu2++2e-═Cu 阳极:4OH--4e-═O2↑+2H2O | |
| C. | 阴极:2H++2e-═H2↑ 阳极:2C1--2e-═Cl2↑ | |
| D. | 阴极:Cu2++2e-═Cu 阳极:2C1--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
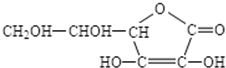
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
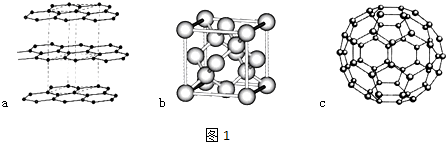
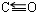 ;写出另一与CO互为等电子体的化学式CN-.
;写出另一与CO互为等电子体的化学式CN-.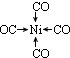 ;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2.
;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2.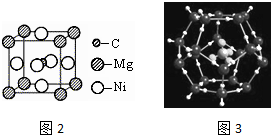
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
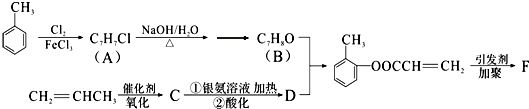
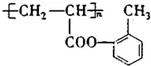
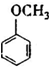 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Na+、NO3-、Fe2+ | B. | Ca2+、Na+、Fe3+、NO3- | ||
| C. | K+、Cl-、HCO3-、NO3- | D. | Mg2+、Cl-、NH4+、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com