

科目:高中化学 来源: 题型:
 硫代硫酸钠溶液与稀硫酸的反应方程式为:Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O,某实验兴趣小组用如图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略).
硫代硫酸钠溶液与稀硫酸的反应方程式为:Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O,某实验兴趣小组用如图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略).| 实验 组号 |
温度 | Na2S2O3溶液 | H2SO4 | 加入H2O的体积 | 出现沉淀所需时间 | ||
| 体积 | 浓度 | 体积 | 浓度 | ||||
| Ⅰ | 0℃ | 5mL | 0.1mol?L-1 | 10mL | 0.1mol?L-1 | 5mL | 8s |
| Ⅱ | 0℃ | 5mL | 0.1mol?L-1 | 5mL | 0.1mol?L-1 | 10mL | 12s |
| Ⅲ | 30℃ | 5mL | 0.1mol?L-1 | 5mL | 0.1mol?L-1 | 10mL | 4s |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
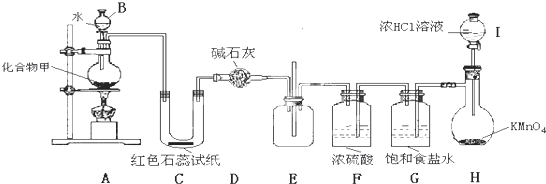
科目:高中化学 来源:2013届江西省上饶市高一下学期期中考试化学试卷 题型:选择题
某实验兴趣小组用如图所示装置做完实验后,在读书卡片上记下了如下6条记录,其中合理的是( )

A.①②③ B、③④⑤ C、④⑤⑥ D、②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com