
| A. | 硅胶可用作食品干燥剂 | B. | 乙醇可作消毒剂 | ||
| C. | 氢氧化铝可作胃酸中和剂 | D. | 二氧化碳可作钠着火的灭火剂 |
分析 A.硅胶无毒,且具有吸水性;
B.乙醇能使蛋白质发生变性;
C.氢氧化铝碱性很弱,可与胃中的盐酸反应;
D.钠燃烧生成过氧化钠,二氧化碳与过氧化钠反应生成氧气.
解答 解:A.硅胶无毒,且具有吸水性,则硅胶可用作食品干燥剂,故A正确;
B.乙醇能使蛋白质发生变性,则乙醇可作消毒剂,故B正确;
C.氢氧化铝碱性很弱,可与胃中的盐酸反应,则氢氧化铝可作胃酸中和剂,故C正确;
D.钠燃烧生成过氧化钠,二氧化碳与过氧化钠反应生成氧气,则二氧化碳不能作钠着火的灭火剂,应利用沙土灭火,故D错误;
故选D.
点评 本题考查有机物的组成、性质及应用,为高频考点,把握物质的性质、发生的反应及用途等为解答的关键,侧重分析与应用能力的考查,注重化学与生活的联系,题目难度不大.


科目:高中化学 来源: 题型:填空题
| 试管A | 试管B | |
| 加入试剂 | ||
| 实验现象(褪色时间) | ||
| 结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ③④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中碳原子不在一条直线上 | B. | 戊烷有三种同分异构体 | ||
| C. | 丙烷比丁烷更易液化 | D. | 新戊烷的沸点比正戊烷的沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要是在加热条件下进行的反应一定是吸热反应 | |
| B. | 一种能量形式可以转化为另外的能量,所以任何反应都可以把化学能转化为电能 | |
| C. | 中和反应和燃烧是放热反应,Ba(OH)2•8H2O与NH4Cl的反应是吸热反应 | |
| D. | 只要反应物的总能量高于生成物的总能量,在任何条件下该反应就能够发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
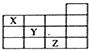
| A. | X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐 | |
| B. | 等物质的量浓度的X、Y、Z的气态氢化物的水溶液的pH:X>Y>Z | |
| C. | Z的单质常温下是液体,可与铁粉反应 | |
| D. | Z的原子序数比Y大9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com