
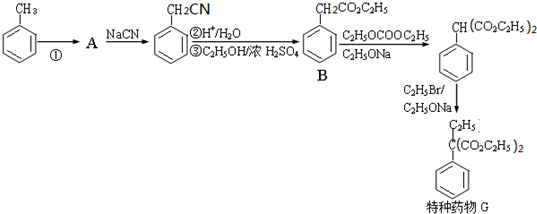
 ,请设计合成路线(无机试剂及溶剂任选).
,请设计合成路线(无机试剂及溶剂任选).
| pb(OAc)4 |
| H2/催化剂 |
| 加热加压 |
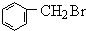 ,再与NCN发生取代反应;
,再与NCN发生取代反应; +HO-C2H5
+HO-C2H5| 浓硫酸 |
| △ |
 +H2O,
+H2O, +HO-C2H5
+HO-C2H5| 浓硫酸 |
| △ |
 +H2O;
+H2O;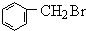 ,再与NCN发生取代反应,故答案为:液溴、光照;
,再与NCN发生取代反应,故答案为:液溴、光照;| △ |
| △ |
 等,
等, 等;
等; ,故答案为:
,故答案为: .
.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、1mol苯分子含有3NA个C-C键 |
| B、一定条件下,1mol N2和3mol H2充分混合,反应后转移的电子数为6NA |
| C、常温下,78.0g Na2O2与58.5g NaCl所含阴离子数相等 |
| D、标准状况下,2.24L CCl4所含分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
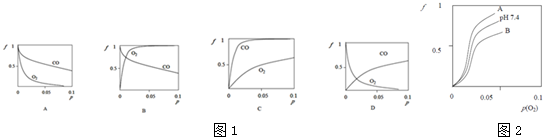
科目:高中化学 来源: 题型:
查看答案和解析>>
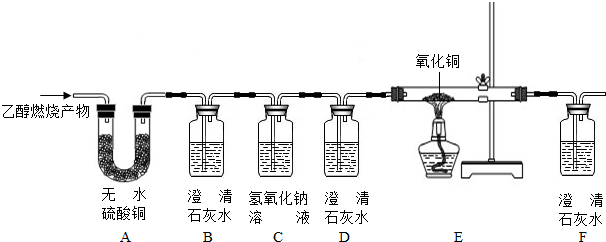
科目:高中化学 来源: 题型:
查看答案和解析>>
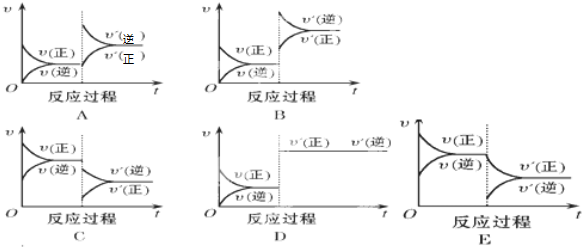
科目:高中化学 来源: 题型:
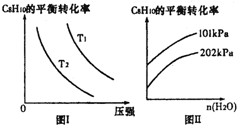 苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 |  选用滴定管 选用滴定管 |
| A | 碱 | 酸 | 石芯 | (乙) |
| B | 酸 | 碱 | 酚酞 | (甲) |
| C | 碱 | 酸 | 甲基橙 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
| 实验 编号 | 待测氢氧化钠溶液体积(mL) | 滴定开始读数(mL) | 滴定结束读数(mL) | 消耗盐酸体积(mL) |
| ① | 25.00 | 0.02 | 26.40 | |
| ② | 25.00 | 0.04 | 25.81 | |
| ③ | 25.00 | 0.03 | 25.78 | |
| ④ | 25.00 | 0.20 | 25.96 |
查看答案和解析>>
科目:高中化学 来源: 题型:
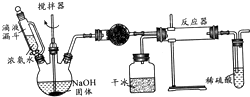 实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.
实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com