
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| | | | |||||||||||||||
| | | | | | a | | b | | |||||||||
| | | c | | | d | e | | ||||||||||
| | | | | | | | | f | | g | | | | | | | |
1) 三角锥 sp3 平面三角形 sp2 非极性分子
(2)HF ,HF中有氢键
(3)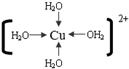 (4)[Co(NH3)5SO4]Br, NH3、SO42-
(4)[Co(NH3)5SO4]Br, NH3、SO42-
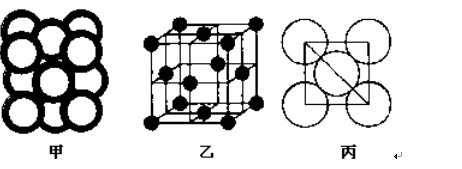
(5) 12、 
解析试题分析:根据元素在周期表中的位置可确定a是N;b是F;c是Al;d是S;e是Cl;f是Co;g是Cu。(1)NH3分子构型为三角锥型;中心原子N的杂化形式为sp3杂化;SO3分子构型为平面三角形;中心原子S的杂化形式为sp2;由于各个化学键的排列是对称的,所以该分子是非极性分子。(2)在HF、H2S、HCl三种物质中由于在HF的分子之间存在氢键,增加了分子之间的相互作用力,所以HF的沸点最高。(3)在溶液中Cu2+是以四水和铜离子的形式存在的,其结构简式是 。(4)Co(NH3)5BrSO4。Co3+ 的配位数是6可形成两种配合物为确定f的配合物的结构,在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,证明SO42-不是配位体;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,证明在化合物中SO42-是配位体。则第二种配合物的化学式[Co(NH3)5SO4]Br;该配合物的配体是NH3及SO42-。(5)Al单质晶体中原子的堆积方式为立方面心堆积。则Al单质晶体中原子的配位数为(3×8)÷2=12;在每个晶胞中含有的Al原子的个数为8×1/8+6×1/2=4.由于的原子半径为r,所以晶胞的边长
。(4)Co(NH3)5BrSO4。Co3+ 的配位数是6可形成两种配合物为确定f的配合物的结构,在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,证明SO42-不是配位体;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,证明在化合物中SO42-是配位体。则第二种配合物的化学式[Co(NH3)5SO4]Br;该配合物的配体是NH3及SO42-。(5)Al单质晶体中原子的堆积方式为立方面心堆积。则Al单质晶体中原子的配位数为(3×8)÷2=12;在每个晶胞中含有的Al原子的个数为8×1/8+6×1/2=4.由于的原子半径为r,所以晶胞的边长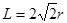 。则该晶体的密度为
。则该晶体的密度为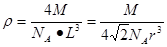 。
。
考点:考查元素的推断、物质的分子结构、晶体结构及晶体密度的计算的知识。


科目:高中化学 来源: 题型:填空题
生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与混合,在含有Zn、Cu等元素的催化剂条件下能合成一种生物质能——甲醇。
(1) 与CO互为等电子体的物质的化学式是 。
(2) CO2分子中碳原子的杂化类型是 杂化。
(3) 按电子排布Zn在元素周期表中属于 区,
其晶体属于六方最密堆积,它的配位数是 。
(4) Cu的一种氯化物晶体的晶胞结构如图所示。(空心球代表氯离子),则一个晶胞中所含的数目是 。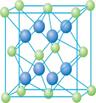
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)元素D在周期表中的位置是 。
(2)该配位化合物的化学式为 。
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 。
(5)已知E的晶胞结构如下图所示,又知晶胞边长为3.61×10-8cm,则E的密度为 ;EDC4常作电镀液,其中DC 的空间构型是 ,其中D原子的杂化轨道类型是 。
的空间构型是 ,其中D原子的杂化轨道类型是 。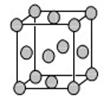
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分)【化学-物质结构与性质】
原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。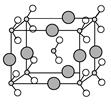
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分)【化学一物质结构与性质】
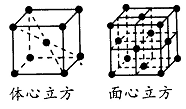
根据物质结构与性质的关系,请回答下列问题:
(1)基态铬(Cr)原子的价电子排布式是________,这样排布使整个体系能量最低,原因是________。
(2)氨水中存在多种形式的氢键,其中与“氨极易溶于水”这种性质相关的氢键可表示为:_________。解释NH3分子中键角大于H2O中的键角的原因是_________ 。
(3)下列各项的比较中正确的是_________。
| A.第一电离能:Mg>Al | B.电负性:P>Ge |
| C.稳定性:AsH3>H2S | D.金属性: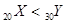 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
Ⅰ.原子半径:A < C< B < E< D
Ⅱ.原子的最外层电子数:A=D C=E A + B=C
Ⅲ.原子的核外电子层数:B=C=2A
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式 ;
(2)写出某黑色含F的磁性氧化物与E最高价氧化物对应水化物的稀溶液反应的离子方程式 。装置1经过一段时间向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。单质F发生 (填电化学腐蚀类型)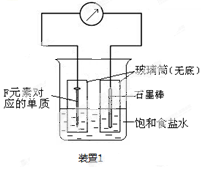
(3)向A、B、C三种元素组成的某盐稀溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为 ,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为 。
(4)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2,则该复盐的化学式为 。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【物质结构与性质】
过渡元素具有较多的空轨道,所以第四周期的Cr、Fe、Co、Ni、Cu、Zn等多种金属能形成配合物。
(1)基态Cu原子的核外电子排布式为 ;
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下: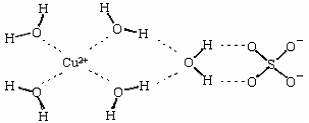
图中虚线表示的作用力为 ;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是 ,其中心原子的杂化轨道类型是 ;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是 , Ni(CO)4易溶于下列 。
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学设计实验以探究元素性质的递变规律,实验装置如图所示。
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。
已知A装置的烧瓶里装有大理石,分液漏斗里装有稀HNO3,B装置中装有饱和碳酸氢钠溶液,装置C中装有Na2SiO3溶液,试回答:
(1)A中反应的离子方程式为____________________,C中可观察到的现象是________。
(2)B装置的作用是__________________________________________________________。
(3)根据实验现象推知,碳酸、硝酸、硅酸的酸性强弱顺序是________,由此得出碳、硅、氮三种元素非金属性的强弱顺序是________。
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱。
(4)写出B装置中发生反应的离子方程式:_______________________________________。
(5)C装置的作用是_________________________________________________________。
(6)实验结论:氧化性:____________________,非金属性:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述错误的是
①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同
| A.①③ | B.②④ | C.②⑤ | D.④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com