
【题目】某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质。设计了如下图所示装置进行实验.
已知:1.0 mol/L的Fe(NO3)3溶液的pH=1。

请回答:
(1)装置A中用于添加浓硫酸的仪器名称为__________________。
(2)实验前鼓入N2的目的是________________________________。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是_________________。
②按观点2,装置B中反应的离子方程式是______________________________,
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号)_____。
A.1 mol/L稀硝酸 |
B.1.5 mol/L Fe(NO3)2溶液 |
C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液 |
D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液 |
【答案】分液漏斗 排净装置中的空气,防止溶液中SO2被空气中的O2氧化而干扰实验 BaSO4 还原 静置一段时间后,溶液由棕黄色变为浅绿色 3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+或3SO2+2NO3-+2H2O=3SO42-+2NO+4H+;Ba2++SO42- = BaSO4↓ C
【解析】
本题以二氧化硫为载体考查了性质实验方案设计,明确实验原理是解本题关键,根据物质的性质进行假设,然后采用验证的方法进行探究,结合氧化还原反应分析解答。
(1)装置A中用于添加浓硫酸,为滴加液体的仪器,该仪器名称为分液漏斗,故答案为:分液漏斗;
(2)氧气、硝酸根离子都能将二氧化硫氧化,所以如果装置中含有氧气,会干扰实验,所以排入氮气的目的是排净空气防止干扰实验,故答案为:排净装置中的空气,防止溶液中SO2被空气中的O2氧化而干扰实验;
(3)二氧化硫具有还原性,酸性条件下,能被硝酸根离子氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀,故答案为:BaSO4;还原;
(4)①若观点1正确,二氧化硫和铁离子发生氧化还原反应生成硫酸根离子和亚铁离子,硫酸根离子和钡离子反应生成白色沉淀,溶液由黄色变为浅绿色,所以除产生沉淀外,还应观察到的现象是静置一段时间后,溶液由棕黄色变为浅绿色,故答案为:静置一段时间后,溶液由棕黄色变为浅绿色;
②按观点2,酸性条件下,硝酸根离子和二氧化硫发生氧化还原反应生成硫酸根离子和NO,硫酸根离子和钡离子反应生成硫酸钡白色沉淀,离子反应方程式为:3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+或3SO2+2NO3-+2H2O═3SO42-+2NO↑+4H+、Ba2++SO42-═BaSO4↓,故答案为:3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+或3SO2+2NO3-+2H2O═3SO42-+2NO↑+4H+、Ba2++SO42-═BaSO4↓;
③乙同学的观点是:酸性条件下,二氧化硫和硝酸根离子发生氧化还原反应,只要溶液中硝酸根离子浓度不变即,实验中c(NO3-)=3mol/L,则可用6.0molL-1NaNO3和0.2molL-1盐酸等体积混合的溶液代替,故答案为:C。


科目:高中化学 来源: 题型:
【题目】已知化学反应的热效应只与反应物的初始状态和生成物的最终状态有关,下列各反应热关系中不正确的是( )

A. A→F ΔH=-ΔH6
B. A→D ΔH=ΔH1+ΔH2+ΔH3
C. ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
D. ΔH1+ΔH6=ΔH2+ΔH3+ΔH4+ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ(1)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
(2)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=_______mol·L1,0.1 mol·L1的(NH4)2SO3溶液显______(填“酸性”、“碱性”或“中性”)。
Ⅱ. 某学生用0.200mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是______ (填编号)。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入______ 中(从图中选填“甲”或“乙”)。

(3)下列操作会引起实验结果偏大的是:______![]() 填编号
填编号![]() 。
。
A. 在锥形瓶装液前,留有少量蒸馏水
B. 滴定前,滴定管尖嘴有气泡,滴定后无气泡
C. 滴定终点俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学电源的雏形。关于如图所示原电池的说法正确的是
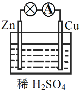
(1)如图连接好装置后,负极材料是__(填“Zn”或“Cu”),铜电极发生的现象:_____。
(2)相应原电池的总反应方程式为____。
(3)下列化学反应可通过原电池装置,可实现化学能直接转化为电能的是__(填序号)
①2NaOH+H2SO4=Na2SO4+2H2O
②Cu+2Fe3+=Cu2++2Fe2+
③C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
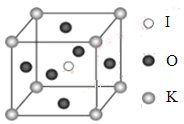
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏伽德罗常数的值。下列叙述正确的是
A. 用铅蓄电池电解氯化钠溶液得到标准状况下22.4L氢气时理论上铅蓄电池中消耗氢离子数目为4NA
B. 1L0.1mol·L-1NH4Cl溶液中含有的氮原子数小于0.1NA
C. 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA
D. 氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)![]() 2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是

A. a、b、c三个状态只有b是平衡状态
B. 达到平衡时A2的转化率大小为:b>a>c
C. 若T2<T1,则正反应一定是吸热反应
D. b点时,平衡体系中A、B原子数之比接近1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如图。该电池工作时,下列说法正确的是( )
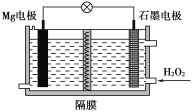
A.Mg电极是该电池的正极B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的碱性增强D.溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年我国科学家研发了一种可充电镁一溴电池,其工作原理如图所示,电池的中间是只允许镁离子通过的离子选择性膜。电池的总反应为Mg+NaBr3===NaBr+MgBr2。下列说法错误的是( )

A. 放电过程中Mg2+通过离子选择性膜从负极区移向正极区
B. 放电时,正极反应式为Br3-+2e-=3Br-
C. 负极区电解液若改为镁盐的水溶液,则会发生副反应:Mg+2H2O===Mg(OH)2+H2↑
D. 充电过程中当0.1molMg2+通过离子选择性膜时,外电路导线中通过0.1mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com