
短周期主族元素X、Y、Z、W的原子序数依次增大。X与W同主族,X、W的单质在标准状况下的状态不同。Y是空气中含量最高的元素,Z原子最外层电子数是其内层电子总数的3倍,Z2-与W+具有相同的电子层结构。下列说法正确的是
A. 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B. 由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性
C. 元素Y的简单气态氢化物的热稳定性比Z的强
D. 化合物X2Z2与W2Z2所含化学键类型完全相同
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源:2017届安徽省高三上学期期中化学试卷(解析版) 题型:选择题
已知在碱性溶液中可发生如下反应:Fe(OH)3+ClO-+OH-→FeO4n-+Cl-+ H2O(未配平)。则有关叙述不正确的是
H2O(未配平)。则有关叙述不正确的是
A.已知FeO4n-中Fe的化合价是+6价,则n=2
B.每产生1molCl-,转移2mol电子
C.FeO4n-具有强氧化性,一般其还原产物为Fe3+,可用作新型自来水消毒剂和净水剂
D.若n=2,该反应中氧化剂与还原剂的物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上第二次月考化学试卷(解析版) 题型:选择题
在恒容密闭容器中通入X并发生反应:2X(g) 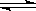 Y(g),在温度T1、T2下,Y的物质的量浓度c(Y)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),在温度T1、T2下,Y的物质的量浓度c(Y)随时间t变化的曲线如图所示,下列叙述正确的是

A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.N点的逆反应速率v逆大于W点的逆反应速率v逆
C.T1 > T2
D.M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上第四次质检化学试卷(解析版) 题型:填空题
CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为 。
②用CO、O2和固体电解质还可以制成如下图1所示的燃料电池,则电极d的电极反应式为 。
(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示。
①在图示2的转化中,化合价不变的元素是 (填元素名称)。
②在转化过程中通入氧气发生反应后,溶液的pH将 (填“增大” 、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为 。
、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为 。
③加入NaClO时发生的反应为:Cu(NH3) +2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
+2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有 、 。

图3
(3)CO与SO2在铝矾土作催化剂、773 K条件下 反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式: 。
反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上第四次质检化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B.向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C.NH4HCO3溶液和过量的NaOH溶液混合:HCO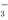 +OH-===CO
+OH-===CO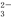 +H2O
+H2O
D.向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I- = 2Fe2++I2
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上第四次质检化学试卷(解析版) 题型:选择题
化学与环境、材料、信息、能源关系密切,下列说法中不正确的是( )
A.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水
B.“光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关
C.尽量使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”宗旨
D.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上10月月考化学试卷(解析版) 题型:选择题
表面介导电池(SMCS)是一种新型充电电池,该电池的电极材料为金属锂和氧化石墨烯.下列有关说法中不正确的是( )
A.放电时,氧化石墨烯作正极
B.放电时,负极电极反应式为Li﹣e-═Li+
C.充电时,该电池是将电能转化为化学能
D.放电时,电解质溶液中的Li+从正极迁移到负极
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
已知:可逆反应N2(g)+3H2(g)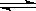 2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1molN2(g)和3molH2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2molNH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是
2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1molN2(g)和3molH2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2molNH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是
A.达平衡时甲中NH3的体积分数为75%
B.达平衡时甲、乙中NH3的体积分数乙>甲
C.达到平衡后,再向乙中加入0.25molN2(g)、0.75molH2(g)和1.5molNH3(g),平衡向生成NH3的方向移动
D.乙中反应的热化学方程式为2NH3(g)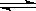 N2(g)+3H2(g);△H=+Q2kJ/mol
N2(g)+3H2(g);△H=+Q2kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:填空题
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L 0.l mol/L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中
[c(CH3COO-)·c(H+)]/c(CH3COOH) (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4-9之间。土壤中Na2CO3含量较高,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ,加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为
(3)常温下在20ml 0.1mo l·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如图所示。

回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为 ,溶液中各种离子的物质的量浓度的大小关系
为 ;
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4mol·L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH= ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com