
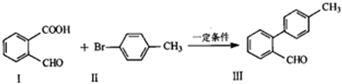
 .
.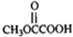 与
与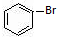 也可以发生类似反应①的反应,有机产物的结构简式为:
也可以发生类似反应①的反应,有机产物的结构简式为: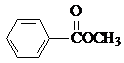 .
.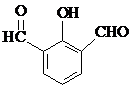 、
、 、
、
分析 (1)I中官能团名称是醛基、羧基;醛基和苯环能和氢气发生加成反应;
(2)III和新制氢氧化铜悬浊液发生氧化反应生成-COONa;
(3)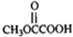 与
与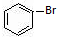 也可以发生类似反应①的反应,则
也可以发生类似反应①的反应,则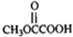 中羧基被苯基取代生成
中羧基被苯基取代生成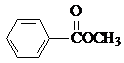
(4)化合物Ⅰ有多种同分异构体,其同分异构体符合下列条件:①能与FeCl3溶液发生显色反应,说明含有酚羟基;②苯环上一氯取代产物有2种,说明苯环上氢原子有两种,据此判断同分异构体.
解答 解:(1)I中官能团名称是醛基、羧基;醛基和苯环能和氢气发生加成反应,所以1 mol化合物Ⅰ完全加成需要消耗4molH2,故答案为:醛基、羧基;4;
(2)III和新制氢氧化铜悬浊液发生氧化反应生成-COONa,反应方程式为化合物Ⅲ中含-CHO,与新制氢氧化铜反应生成砖红色氧化亚铜沉淀,该反应为 ,
,
故答案为: ,
,
(3)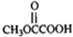 与
与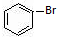 也可以发生类似反应①的反应,则
也可以发生类似反应①的反应,则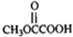 中羧基被苯基取代生成
中羧基被苯基取代生成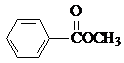
故答案为: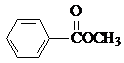
(4)化合物Ⅰ有多种同分异构体,其同分异构体符合下列条件:①能与FeCl3溶液发生显色反应,说明含有酚羟基;②苯环上一氯取代产物有2种,说明苯环上氢原子有两种,符合条件的结构简式有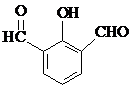


故答案为: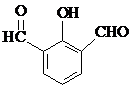


点评 本题考查有机物结构和性质,为高频考点,侧重考查官能团及其性质关系及同分异构体书写,难点是(4)题同分异构体种类判断,题目难度不大.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:解答题
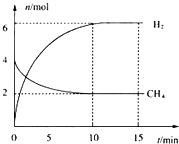 碱金属元素的单质及其化合物被广泛应用于生产、生活中.
碱金属元素的单质及其化合物被广泛应用于生产、生活中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
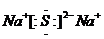 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,CH3CH(C2H5)CH2CH(CH3)2的命名为:2-甲基-4-乙基戊烷 | |
| B. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 | |
| C. |  的单体是CH3-C=C-CH3和CH2=CH-CN 的单体是CH3-C=C-CH3和CH2=CH-CN | |
| D. | 已知 可使Br/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳酸双键 可使Br/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳酸双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
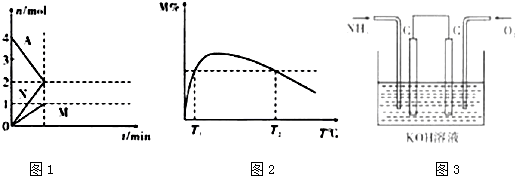
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
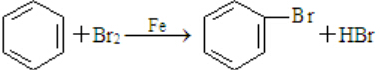 ;
; .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

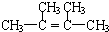 .
. 为不稳定结构.
为不稳定结构. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com