
分析 ①A.根据加入石灰石作为脱硫剂,可以减少SO2的排放,防止酸雨的产生进行解答;
B.采用光电转化装置,属于清洁能源,减少电煤的使用,有利于改善环境质量;
C.根据通过露天焚烧或深埋的方式进行处理垃圾,会污染大气、水体和土壤解答;
D.根据使用降解的新型聚合材料,可以减少白色污染进行解答;
②使其中的有害气体NO、CO转化为无害气体,可生成N2和CO2;
③人造板材会释放出有害物质甲醛;
④漂白粉的有效成分为次氯酸钙,铝离子水解生成氢氧化铝胶体,胶体具有吸附性而净水.
解答 解:①A.在燃煤中添加石灰石粉末可减少二氧化硫的排放,以减少酸雨的发生,有利于改善环境质量,故A正确;
B.为实现“低碳世博”,上海世博会很多展馆采用光电转化装置,属于清洁能源,减少电煤的使用,有利于改善环境质量,故B正确;
C.对所有垃圾通过露天焚烧或深埋的方式进行处理,会污染大气、水体和土壤,不利于改善环境,故C错误;
D.利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯,可减少白色污染,故D正确.
故答案为:C;
②使其中的有害气体NO、CO转化为无害气体,可生成N2和CO2,反应的方程式为2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,
故答案为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
③人造板材会释放出甲醛(或CH2O、HCHO),是一种致癌物质,
故答案为:甲醛(或CH2O、HCHO);
④漂白粉的有效成分为Ca(ClO)2,铝离子水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水中悬浮物而净水,水解方程式为A13++3H2O?Al(OH)3(胶体)+3H+,
故答案为:Ca(ClO)2;A13++3H2O?Al(OH)3(胶体)+3H+.
点评 本题考查环境污染知识,题目难度不大,学习中注意相关基础知识的积累,注意甲醛对人体的危害.


科目:高中化学 来源: 题型:选择题
| A. | 过量的CO2通入Na2SiO3溶液中 | |
| B. | 向AlCl3溶液中滴加稀氨水至过量 | |
| C. | 少量的CO2通入BaCl2溶液中 | |
| D. | 向FeCl3溶液中滴加NaOH溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

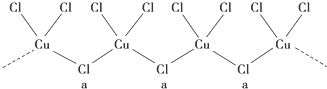
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为p轨道是“8”字形的,所以p的电子走“8”字形 | |
| B. | K能级有3s,3p,3d,3f四个轨道 | |
| C. | 碳原子的2p轨道上有两个自旋相反的电子 | |
| D. | 以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
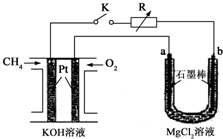 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.请回答下列问题:
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com