
分析 加热条件下,MnO2和浓盐酸发生氧化还原反应生成MnCl2、Cl2和H2O,该反应中Mn元素化合价由+4价变为+2价、Cl元素由-1价变为0价;氯气和水反应生成具有强氧化性的次氯酸,可用于杀菌消毒,以此解答该题.
解答 解:加热条件下,MnO2和浓盐酸发生氧化还原反应生成MnCl2、Cl2和H2O,反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,该反应中Mn元素化合价由+4价变为+2价、Cl元素由-1价变为0价,得电子化合价降低的反应物是氧化剂,所以MnO2是氧化剂,而HCl为还原剂;
氯气可用于自来水的杀菌消毒,由Cl2+H2O=HCl+HClO,氯气与水反应生成次氯酸,HClO具有强氧化性,可用于杀菌消毒,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;MnO2;HCl;Cl2+H2O=HCl+HClO,氯气与水反应生成次氯酸,HClO具有强氧化性,可用于杀菌消毒.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意性质与用途的关系,题目难度不大.


科目:高中化学 来源: 题型:填空题
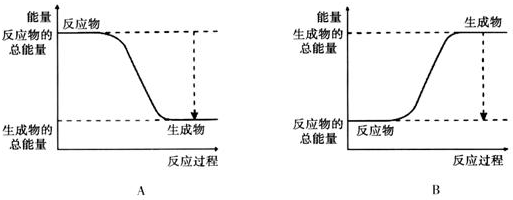
| 化学键 | H-H | O═O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
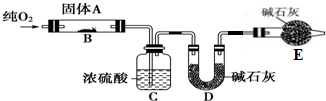
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
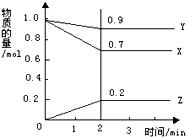 某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为:X+3Y?2Z.反应开始至2min,Z的平均反应速率为0.05mol/(L.min).
某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为:X+3Y?2Z.反应开始至2min,Z的平均反应速率为0.05mol/(L.min).查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
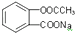 转化为
转化为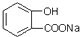 应选用的试剂和操作的是( )
应选用的试剂和操作的是( )| A. | 加入足量的NaOH共热后,再通入足量的CO2 | |
| B. | 溶解,加热后通足量的CO2 | |
| C. | 与稀H2SO4共热后加足量的 NaOH | |
| D. | 与稀H2SO4共热后加足量的Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com